تطبيقات الخلايا الجلفانية
Galvanic Cells Applications
البطاريات Batteries
تعد البطاريات تطبيقاً عملياً على الخلايا الجلفانية، حيثُ تتحوَّلُ الطاقة الكيميائية فيها إلى طاقة كهربائية.
ولعمل بطارية يلزم توفر شرطين، هما:
1- فلزان مختلفان في قابليتهما لفقد الإلكترونات.
2- محلول لمادة موصلة للتيار الكهربائي (محلول كهرلي).
خلية الليمون
يمكن إنتاج تيار كهربائي من حبة ليمون طرية، وصفيحتين من فلزين مختلفين؛ كالخارصين والنحاس.
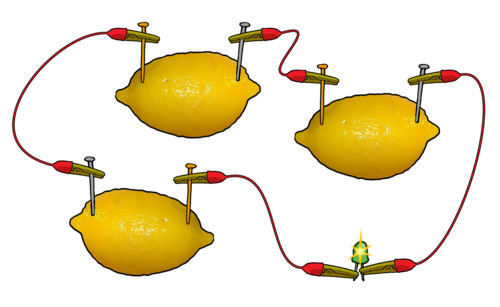
إلا أن قيمة فرق الجهد الناتج من بطارية الليمون لا تتجاوز قيمته (1) فولت، ويمكن لهذا الجهد أن يشغل ساعة.
أنواع البطاريات
وهناك أنواع مختلفة من البطاريات، منها:
1- البطاريات الأولية:
وهي البطاريات التي لا يمكن إعادة شحنها عندما تَنفَدُ، مثل البطارية الجافة.
2- البطاريات الثانوية:
وهي البطاريات القابلة لإعادة الشحن، مثل بطارية السيارة.
البطارية الجافة Dry Battery
تُعَدُّ البطارية الجافة من أقدم أنواع البطاريات وأكثرها استخدامًا.
أشهر أمثلتها: بطارية (خارصين - جرافيت).
فرق الجهد الذي تعطيه البطارية: في 1.5 V.
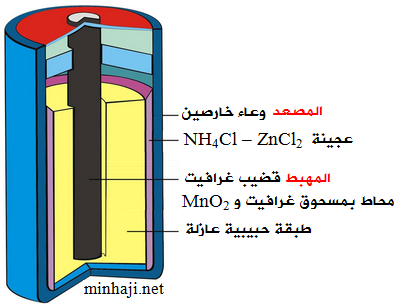
أجزاء البطارية الجافة:
أ- مهبط (+): يتكون من قطب من الجرافيت، ويحاط بعجينة رطبة من مزيج من أكسيد المنغنيز MnO2 IV ومسحوق الجرافيت (الكربون).
ب- مصعد (-): يتكوّن من وعاءٍ أسطوانى من فلز الخارصين، ويفصله عن العجينةِ الرَّطْبة غشاء شبه منفذ.
ج- مادة كهرلية: عجينةٌ رَطْبَةٌ من مزيج من مادتي كلوريد الأمونيوم NH4Cl وكلوريد الخارصين ZnCl2، ولها خصائص حمضية.
بطارية السيارة (بطارية الرصاص الحمضية) Lead-Acid Battery
تعتبر بطارية السيارة بطارية ثانوية يعاد شحنها.
فرق الجهد الذي تعطيه البطارية: 12V ، فهي تحتوي على (6) خلايا.
أجزاء بطارية الرصاص الحمضية:
أ- مهبط (+): ألواح من الرصاص مغطاة بأكسيد الرصاص PbO2 .
ب- مصعد (-): ألواح من الرصاص Pb .
ج- المحلول الكهرلي: حمض الكبريتيك H2SO4 .
التفاعل الكلي في بطارية الرصاص الحمضية:
Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
خلية الوقود Fuel Cell
تُعَدُّ خلية الوقودِ خليةً جلفانية، لكنها تختلف عن غيرها بتزودها بالمواد المتفاعلة أو الوقود باستمرار، وهو غالبًا غاز الهيدروجين.
أجزاء خلية الوقود:
المصعد: قطب من البلاتين ويحدث عليه تأكسد للهيدروجين.
المصعد: قطب من البلاتين ويحدث عليه تأكسد للأكسجين.
المحلول الكهرلي: محلول من هيدروكسيد البوتاسيوم KOH.
يَضُخُ غاز الهيدروجين إلى المصعد وغاز الأكسجين إلى المهبط في الخلية، وعليه، تحدث التفاعلات الآتية:
تفاعل التأكسد / المصعد :
2H2(g) + 4OH-(aq) → 4H2O(l) + 4e-
تفاعل الاختزال المهبط:
O2(g) + 2H2O(l) + 4e- → 4OH-(aq)
التفاعل الكلي:
2H2(g) + O2(g) → 2H2O(l)
استخدامات خلايا الوقود:
- تُستخدم في المَرْكبات الفضائية للحصول على الطاقة، كما يستفيد روّاد الفضاء من الماء الناتج للشرب.
- في بعض الدول تُستخدَمُ في وسائل النقل، مثل السيارات والباصات،
- تُستخدم مصدرًا احتياطيًا للطاقة للتشغيل عند الضرورة.
مميزات خلايا الوقود:
- تتميز خلية الوقود بأنها غير ملوثة.
- تنتج كمية كبيرة من الطاقة.
إعداد : شبكة منهاجي التعليمية
05 / 06 / 2023
النقاشات