إجابات أسئلة مراجعة الدرس الأول
التأكسد والاختزال والخلايا الجلفانية
السؤال الأول:
الفكرة الرئيسة: كيف تنتج الخلايا الجلفانية تيارًا كهربائياً؟
تنتج الخلايا الجلفانية تيارًا كهربائياً عن طريق تحويل الطاقة الكيميائية (تفاعل تأكسد واختزال) إلى طاقة كهربائية.
السؤال الثاني:
أوضح المقصود بكل من:
أ- الخلايا الكهر كيميائية.
الخلايا الكهركيميائية: الأداة التي تحدث فيها تفاعلات تأكسد واختزال وهي مُنتجة للطاقة الكهربائية أو مستهلكة لها.
ب- المصعد.
المصعد: القطب الذي تحدث عنده عملية التأكسد.
ج- العامل المؤكسد.
العامل المؤكسد: المادة التي تختزل وتسبب تأكسد غيرها.
السؤال الثالث:
أقارن: أملأ الجدول الآتي الذي يتضمن المقارنة بين التأكسد والاختزال:

السؤال الرابع:
أحدد المادة التي تأكسدت والمادة التي اختزلت في المعادلة الكيميائية الآتية:
Zn(s) + CuO(s) → ZnO(s) + Cu(s)
المادة التي تأكسدت: (Zn)، المادة التي اختزلت: (Cu)، ويحدث الاختزال فعلياً لأيون النحاس (Cu2+).
السؤال الخامس:
أحدد المادة التي تأكسدت والمادة التي اختزلت في نصفي التفاعلين الآتيين:
F2(g) + 2e- → 2F-(aq)
Cd(s) → Cd2+(aq) + 2e-
المادة التي تأكسدت: (F2)، المادة التي اختزلت: (Cd).
السؤال السادس:
أستنتج العامل المختزل والعامل المؤكسد في المعادلة الكيميائية الآتية:
Mg(s) + Pb2+(aq) → Mg2+(aq) + Pb(s)
العامل المؤكسد: (Pb2+)، العامل المختزل: (Mg).
السؤال السابع:
وزعت صفائح فلزية للعناصر: (نحاس Cu، رصاص Pb، ألمنيوم AI، خارصين Zn) على مجموعات الطلبة في الصف، وطلب إلى كل مجموعة:
- تشكيل خلية جلفانية بسيطة مختلفة باستخدام زوج من الفلزات ومحلول كهرلي مناسب (يمكن استخدام أملاح نترات الفلزات، إذ إن جميع النترات تذوب في الماء).
- تنظيم المعلومات الخاصة بالخلية في الجدول الآتي:

- الاستعانة بسلسلة النشاط الكيميائي وبالجدول للإجابة عن الأسئلة الآتية:
أ- أستنتج عدد الخلايا الجلفانية التي يمكن تكوينها.
(6) خلايا.
ب- أستنتج: أملأُ الجدول بحيث يتضمن المعلومات الخاصة بكل خلية.
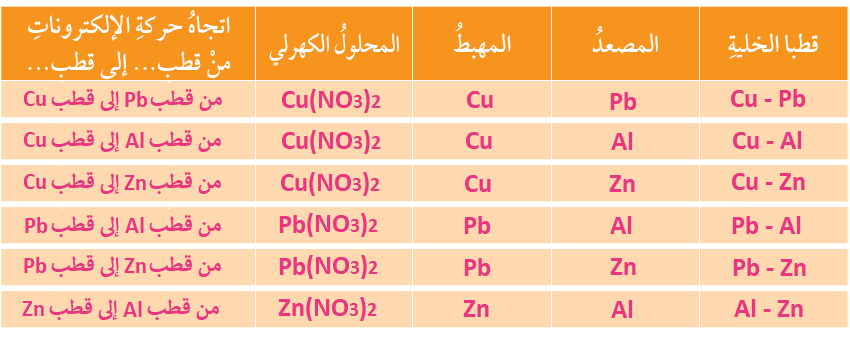
ج- أحدد الفلزين اللذين يشكلان قطبي الخلية الجلفانية التي تنتج أعلى فرق جهد كهربائي. أبرر إجابتي.
الخلية الجلفانية المكونة من قطبي (Al) و (Cu)؛ لأن الألمنيوم أكثر الأقطاب ميلاً للتأكسد، والنحاس أقل الأقطاب ميلاً للتأكسد.
أو فرق النشاط الكيميائي بين قطبي الألمنيوم والنحاس أكبر ما يمكن.
السؤال الثامن:
خلية جلفانية بسيطةٌ قطباها القصدير Sn والنحاس Cu مغموسانِ في محلول كهرلي، عند تشغيل الخلية لوحظ أن اتجاه حركة مؤشر الفولتميتر من قطب القصدير إلى قطب النحاس، علمًا أَن شحنة أيون Sn هي +2 بناءً على ذلك، أجيب عن الأسئلة الآتية:
أ- أحدد المصعد والمهبط وشحنتيهما في الخلية.
المصعد: قطب (Sn) وشحنته (-)، المهبط: قطب (Cu) وشحنته (+).
ب- أقترحُ المحلول الكهرلي الذي يمكن استخدامه في هذِهِ الخلية.
محلول Cu(NO3)2
ج- أكتب نصفي تفاعل التأكسد والاختزال.
Cu2+(aq) + 2e- → Cu(s)
Sn(s) → Cn2+(aq) + 2e-
د- أكتب التفاعل الكلي الذي يحدث في الخلية الجلفانية.
Sn(s) + Cu2+(aq) → Sn2+(aq) + Cu(s)
هـ- أستنتج التغير في كتلة Sn بعد انتهاء التجربة.
تقل.
السؤال التاسع:
الجدول السابق يوضح فرق الجهد الكهربائي الناتج من أربع خلايا جلفانيةٍ بسيطةٍ مكونةٍ من أزواج من الفلزات: B,C,D,A علماً أن A أقل هذه الفلزات نشاطًا، وأنَّ جميع هذه الفلزات تكون أيونات شحنتها +2، أتأمله جيدًا، ثم أجيب عن الأسئلة الآتية:
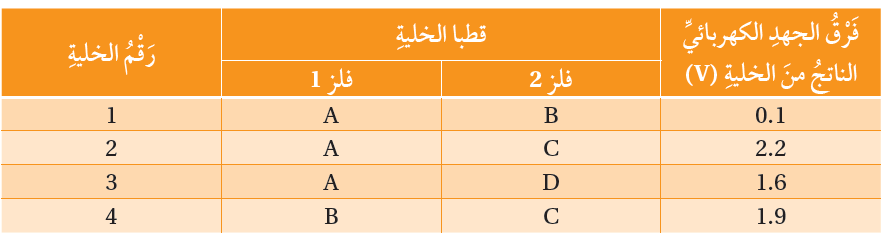
أ- أستنتج رمز الفلز الأكثر نشاطًا، ثم أفسر إجابتي.
الفلز C أكثر نشاطاً؛ لأن فرق الجهد بينه وبين القطب A أكبر قيمة.
ب- أرتب الفلزات وفقًا لتزايد نشاطها الكيميائي.
A < B < D < C
ج- أرسم خلية جلفانية بسيطة تمثل الخلية (3)، ثم أوضح عليها: المصعد، والمهبط، والمحلول الكهرلي المقترح، واتجاه حركة الإلكتروناتِ عَبْرَ الأسلاك، وقراءة الفولتميتر.
المصعد: قطب (D) المهبط: قطب (A).
المحلول الكهرلي المقترح: A(NO3)2
د- أستنتج: أكتب رمزي المصعد والمهبط في الخلية B-C.
المصعد: قطب (C) المهبط: قطب (B).
إعداد : شبكة منهاجي التعليمية
30 / 03 / 2025
النقاشات
Huda Zawahreh
يعطيكم العافيه
إضافة رد
1 ردود
ام علي الرواشده الرواشده
الله يسلمك ويسعدك يعافيكي يارب