إجابات مراجعة الوحدة الأولى
الحموض والقواعد
السؤال الأول:
أوضح المقصود بكل ممّا يأتي:
- قاعدة لويس.
- حمض لويس.
- مادة أمفوتيرية.
قاعدة لويس: مادة يمكنها منح زوج إلكترونات أو أكثر في التفاعل.
حمض لويس: مادة يمكنها استقبال زوج إلكترونات أو أكثر في التفاعل.
مادة أمفوتيرية: مادة تسلك كحمض في تفاعل وتسلك كقاعدة في تفاعلات أخرى.
السؤال الثاني:
أفسر:
أ- السلوك الحمضي لمحلول HNO2 حسب مفهوم برونستد - لوري.
لقدرته على منح بروتون أثناء التفاعل (مانح بروتون).
ج- السلوك الأمفوتيري لتفاعل HS- عند تفاعله مع كل من HCl و NO2- .
لقدرته على استقبال بروتون من الحمض HCl ، ومنع بروتون للأيون NO2- .
السؤال الثالث:
أحدد الأزواج المترافقة في التفاعلات الآتية:
HNO2 (aq) + CN- (aq) NO2- (aq) + HCN (aq)
C5H5N (aq) + HCl (aq) C5H5NH+ (aq) + Cl- (aq)
التفاعل الأول: (HNO2/NO2-) و (CN-/HCN).
التفاعل الثاني: (C5H5N/C5H5NH+) و ( HCl/Cl-).
السؤال الرابع:
أحدد حمض لويس وقاعدته في التفاعل الآتي:
HgI2 (s) + 2I- (aq) HgI42- (aq)
حمض لويس: HgI2
قاعدة لويس: I-
السؤال الخامس:
أحسب الرقم الهيدروجيني لمحلول هيدروكسيد الصوديوم NaOH مكون بإذابة 4 g منه في 200 mL من الماء.
علماً أن الكتلة المولية للقاعدة 40 g/mol = NaOH . (log 2 = 0.3)
أحسب عدد مولات القاعدة (n) في المحلول:
n = = = 0.1 mol
أحسب تركيز القاعدة (M) في المحلول:
M = = = 0.5 M
معادلة تأين القاعدة:
NaOH Na+ + OH-
[OH-] = [NaOH] = 0.5 M
[H3O+] [OH-] = 1 x 10-14 Kw =
[H3O+] = = = 2 x 10-14 M
pH = - log [H3O+] = - log (2 x 10-14) = 14 – log 2 = 14 - 0.3 = 13.7
السؤال السادس:
أحسب. جرت معايرة 10 mL من محلول LiOH ، فتعادلت مع 20 mL من محلول HBr تركيزه 0.01 M أحسب تركيز المحلول LiOH .
عند نقطة التعادل يكون:
عدد مولات الحمض = عدد مولات القاعدة
n (LiOH) = n (HBr)
(M x V) LiOH = (M x V) HBr
(M x 0.01) = (0.01 x 0.02)
MLiOH = 0.02 M
السؤال السابع:
أضيف 40 mL من محلول KOH تركيزه 0.4 M إلى 20 mL من محلول HBr تركيزه 0.5 M أحسب قيمة pH للمحلول الناتج.
أحسب عدد مولات القاعدة:
n (LiOH) = M x V = 0.4 x 0.04 = 0.016 mol
أحسب عدد مولات الحمض:
n (HBr) = M x V = 0.5 x 0.02 = 0.010 mol
أحسب عدد مولات القاعدة الفائضة عن التعادل:
n (LiOH) = 0.016 – 0.010 = 0.006 mol
أحسب تركيز القاعدة الفائضة من عدد مولاتها والحجم الكلي:
M (LiOH) = 0.006 / 0.06 = 0.1 M = [OH-]
أحسب تركيز أيون الهيدرونيوم من علاقة Kw :
Kw = [H3O+] [OH-] = 1 x 10-14
[H3O+] = = = 1 x 10-13 M
pH = - log [H3O+] = - log (1 x 10-13) = 13
السؤال الثامن:
تمثل المعادلات الآتية تفاعلات لمحاليل الحموض (H2SO3 , HCN , HF) المتساوية التركيز، التي كان موضع الاتزان مزاحاً فيها جهة المواد الناتجة لجميع التفاعلات. أدرس التفاعلات، ثم أجيب عن الأسئلة التي تليها:
H2SO3 + CN- HSO3- + HCN
H2SO3 + F- HSO3- + HF
HF + CN- F- + HCN
أ- أكتب صيغة القاعدة المرافقة الأقوى بينها.
القاعدة المرافقة الأقوى: CN-
ب- أكتب صيغة الحمض الذي له أعلى Ka .
حمض H2SO3
ج- أحدد أي المحلولين يكون فيه [OH-] الأقل: محلول HF أم محلول HCN .
محلول حمض HF
د- أحدد أي محاليل الحموض المذكورة له أعلى pH .
محلول حمض HCN
السؤال التاسع:
يبين الجدول الآتي الرقم الهيدروجيني لعدد من المحاليل المختلفة المتساوية التركيز. أدرسها، ثم أختار منها المحلول الذي تنطبق عليه فقرة من الفقرات الآتية:
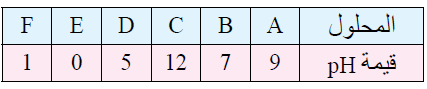
أ- قاعدة يكون فيها [OH-] = 1 x 10-5 M
A
ب- المحلول الذي يمثل الملح KBr
B
ج- محلول حمض HNO3 تركيزه 1 M
E
د- محلول قاعدي تركيز [H3O+] فيه أقل ما يمكن.
C
هـ- محلول أيوناته لا تتفاعل مع الماء.
B
السؤال العاشر:
يحتوي الجدول الآتي على معلومات تتعلق ببعض الحموض والقواعد الضعيفة. أدرس المعلومات، ثم أجيب عن الأسئلة التي تليها:
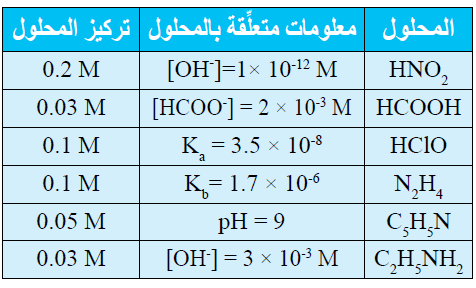
أ- أحسب تركيز [H3O+] في محلول HClO .
أكتب معادلة تأين الحمض:
HClO + H2O H3O+ + ClO-
أكتب قانون ثابت الاتزان:
Ka = = [H3O+] = [ClO-]
أعوض التراكيز عند الاتزان، وقيمة Ka :
3.5 x 10-8 =
[H3O]2 = 3.5 x 10-8 x 0.1 = 35 x 10-10
وبأخذ جذر الطرفين:
[H3O+] = 5.91 x 10-5 M
ب- أحدد أي المحلولين يحتوي على تركيز أعلى من [OH-] : محلول HClO أم محلول HNO2 .
محلول HClO
ج- أحدد أي الملحين أكثر قدرة على التميه: KNO2 أم HCOOK
الملح HCOOK
د- أقرر أيها أقوى: الحمض المرافق للقاعدة C5H5N أم الحمض المرافق للقاعدة C2H5NH2 .
الحمض المرافق للقاعدة C5H5N
هـ- أحدد أي المحلولين يحتوي على تركيز أعلى من [H3O+] : محلول C5H5N أم محلول C2H5NH2 .
محلول C5H5N
و- أحدد أي المحلولين له أعلى رقم هيدروجيني (pH): محلول N2H5Cl أم C2H5NH2 .
محلول C2H5NH2
السؤال الحادي عشر:
أتوقع ما يحدث لقيمة pH في الحالات الآتية (تقل، تزداد، تبقى ثابتة): (أهمل التغير في الحجم)
- إضافة كمية قليلة من بلورات الملح NaHCO3 إلى 500 mL من محلول الحمض H2CO3 .
(تزداد).
- إضافة كمية قليلة من بلورات الملح N2H5NO3 إلى 500 mL من محلول القاعدة N2H4 .
(تقل).
- إضافة كمية قليلة من بلورات الملح LiCl إلى 500 mL من محلول الحمض HCl .
(تبقى ثابتة).
السؤال الثاني عشر:
يحتوي الجدول الآتي على عدد من المحاليل تركيز كل منها 1 M وبعض المعلومات المتعلقة بها. أدرس المعلومات، ثم أجيب عن الأسئلة الآتية:
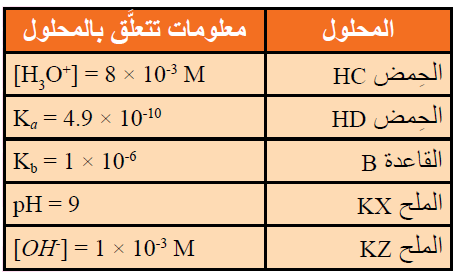
أ- أيهما أضعف الحمض HX أم الحمض HZ ؟
HZ
ب- أكتب معادلة لتفاعل محلول الحمض HD والأيون C- ، ثم:
HD + C- D- + HC
- أحدد الزوجين المترافقين في المحلول.
(HD/D-)، (C-/HC)
- أتوقع الجهة التي يرجحها الاتزان في التفاعل. نحو اليسار (المتفاعلات)
ج- أستنتج القاعدة المرافقة الأضعف: D- أم C- .
D-
السؤال الثالث عشر:
أختار الإجابة الصحيحة لكل فقرة في ما يأتي:
1- يكون تركيز الأيونات الناتجة عن تأين أحد المحاليل الآتية في الماء عند الظروف نفسها أعلى ما يمكن:
أ) NH3
ب) NaOH (القاعدة قوية تتفكك كلياً في الماء)
ج) HCOOH
د) HClO
2- العبارة الصحيحة، في المعادلة (HA + H2O H3O+ + A-)، هي:
أ) يتأين الحمض HA كلياً.
ب) الحمض HA يختفي من المحلول.
ج) الحمض HA ضعيف. (الأسهم متعاكسة في المعادلة، فالحمض ضعيف)
د) لا يوجد أزواج مترافقة في المعادلة.
3- القاعدة المرافقة الأضعف في ما يأتي، هي:
أ) NO3- (القاعدة ناتجة من حمض قوي)
ب) OCl-
ج) F-
د) CN-
4- المحلول الذي لم يتمكن مفهوم أرهينيوس من تفسير سلوكه، هو:
أ) HCl
ب) NaCN (لم يفسر أرهينيوس سلوك الأملاح)
ج) HCOOH
د) NaOH
5- أحد الأيونات الآتية لا يعد أمفوتيرياً:
أ) H2PO4-
ب) HS-
ج) HCO3-
د) HCOO- (ذرة الهيدروجين في أيون الكربوكسيل غير قابلة للتأين)
6- المادة التي تتأين في الماء وتنتج أيون الهيدروكسيد (OH-)، هي:
أ) حمض أرهينيوس.
ب) قاعدة لويس.
ج) قاعدة أرهينيوس.
د) قاعدة برونستد - لوري.
7- المادة التي تستطيع استقبال زوج من الإلكترونات غير رابط من مادة أخرى، هي:
أ) F-
ب) Cu2+ (لأنه أيون عنصر انتقالي يحتوي على فلك فارغ)
ج) BF4-
د) CO32-
8- إذا كان [H3O+] = 2 x 10-2 M في محلول ما، فإن [OH-] هو:
أ) 1 x 10-2 M
ب) 2 x 10-12 M
ج) 1 x 10-10 M
د) 5 x 10-13 M
9- محلول حمض HBr :
أ) عدد مولات H3O+ تساوي فيه عدد مولات OH-
ب) عدد مولات H3O+ أقل فيه عدد مولات OH-
ج) عدد مولات H3O+ تساوي فيه عدد مولات HBr المذابة
د) عدد مولات Br- تساوي فيه عدد مولات OH-
10- المحلول الذي له أعلى pH في المحاليل الآتية التي لها التركيز نفسه، هو:
أ) NH4Cl
ب) HBr
ج) NaCl
د) NH3 (الأمونيا قاعدة)
11- المحلول الذي له أقل قيمة pH في المحاليل الآتية المتساوية في التركيز، هو:
أ) KNO3
ب) NaOH
ج) HNO2
د) HNO3 (حمض النيتريك حمض قوي)
12- المحلول الذي له أقل تركيز H3O+ في المحاليل الآتية المتساوية التركيز، هو:
أ) HCl
ب) N2H5Br
ج) KNO2 (لأنه ملح قاعدي)
د) NH4Cl
13- ترتيب المحاليل المائية للمركبات الآتية (LiOH , N2H5Cl , KNO2 , NaCl) المتساوية في التركيز حسب رقمها الهيدروجيني pH ، هو:
أ) KNO2 > N2H5Cl > NaCl > LiOH
ب) LiOH > KNO2 > N2H5Cl > NaCl
ج) N2H5Cl > NaCl > KNO2 > LiOH
د) LiOH > KNO2 > NaCl > N2H5Cl (قاعدة قوبة ثم ملح قاعدي ثم ملح متعادل ثم محل حمضي)
إعداد : شبكة منهاجي التعليمية
31 / 01 / 2023
النقاشات