محاليل الأملاح
الأملاح: مركبات أيونية تنتج من تفاعل محلول حمض مع محلول قاعدة.
أهمية الأملاح لجسم الإنسان
1- للأملاح دور مهم في تنظيم الكثير من العمليات الحيوية التي تحدث في الجسم.
2- أملاح الكالسيوم تدخل في تركيب العظام والأسنان.
3- أملاح الصوديوم تساعد على حفظ التوازن المائي داخل الخلية وخارجها، وتعمل على تنظيم ضغط الدم.
4- تساعد أملاح البوتاسيوم على ضبط وظائف العضلات وتوسيع الأوعية الدموية لتسهيل انتقال الدم.
أهمية الأملاح في الصناعة
1- تدخل في صناعة الأدوية.
2- تدخل في صناعة مستحضرات التجميل.
لمحاليل الأملاح خصائص حمضية أو قاعدية أو متعادلة.
وبشكل عام:
- تنتج الأملاح القاعدية من تفاعل قاعدة قوية وحمض ضعيف، وينتج عن إذابتها في الماء أيونات OH-
- تنتج الأملاح الحمضية من تفاعل حمض قوي وقاعدة ضعيفة، وينتج عن إذابتها في الماء أيونات H3O+
- تنتج الأملاح المتعادلة من تعادل حمض قوي مع قاعدة قوية، ولا ينتج عن إذابتها في الماء أيونات H3O+ أو OH-
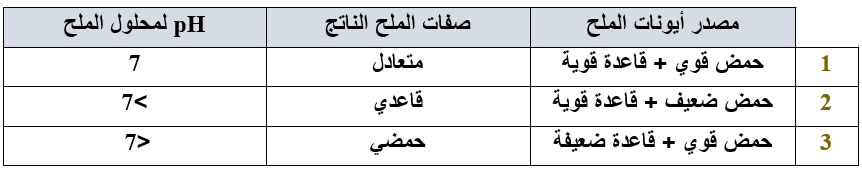
لتحديد طبيعة الملح نرجعه إلى أصله.

تُرتب محاليل الأملاح المتساوية في التركيز حسب قيمة pH على النحو التالي:
الملح القاعدي < الملح المتعادل < الملح الحمضي
تتفاوت الأملاح في قدرتها على التأين في الماء، فبعضها يتأين كلياً وبعضها يتأين جزئياً (سنهتم فقط بالأملاح التي تتأين كلياً).
تفسير برونستد - لوري لسلوك الأملاح
فسر برونستد - لوري سلوك الأملاح تبعاً لقدرة أيوناتها على منح البروتون أو استقباله.
فعند إذابة الملح في الماء تنتج أيونات موجبة وأخرى سالبة، قد تتفاعل مع الماء وتنتج أيونات H3O+ أو OH- أو كليهما، وهو ما يعرف بالتميه، ويحدث في الأملاح القاعدية والحمضية. وقد يذوب الملح في الماء وينتج أيونات موجبة وأخرى سالبة، ليس لها القدرة على التفاعل مع الماء فلا تنتج أيونات H3O+ أو OH- وهو ما يعرف بالذوبان، ويحدث في الأملاح المتعادلة.
التميه: تفاعل أيونات الملح مع الماء، وإنتاج أيونات H3O+ أو OH- أو كليهما.
الذوبان: تفكك الملح في الماء إلى أيونات، ليس لها القدرة على إنتاج أيونات H3O+ أو OH- .
الأملاح المتعادلة
تنتج الأملاح المتعادلة من تعادل حمض قوي مع قاعدة قوية.
مثال:
ملح NaBr ينتج من تعادل الحمض القوي HBr مع القاعدة القوية NaOH. (تفاعل إحلال مزدوج)
HBr (aq) + NaOH (aq) → NaBr (aq) + H2O (l)
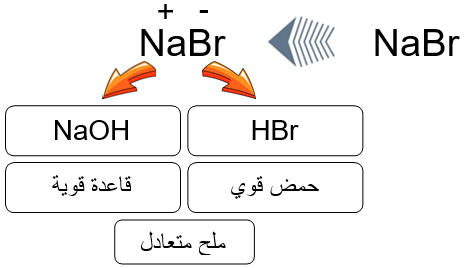
تفسير السلوك المتعادل لملح NaBr
عند إذابة الملح NaBr في الماء ينتج الأيونين Na+ و Br-
NaBr Na+ (aq) + Br- (aq)
- الأيون Br- قاعدة مرافقة ضعيفة لحمض قوي (HBr) ليس له القدرة على الارتباط مع البروتون، فلا يتفاعل مع الماء، ولا ينتج أيونات H3O+ أو OH- .
- الأيون Na+ مصدره القاعدة القوية (NaOH) ليس له القدرة على التفاعل مع الماء، فلا ينتج أيونات H3O+ أو OH- .
وعليه فإن الملح NaBr متعادل لا يؤثر في تركيز كل من H3O+ أو OH- ولا يؤثر في قيمة pH عند إذابته في الماء.
الأملاح القاعدية
تنتج الأملاح القاعدية من تفاعل قاعدة قوية مع حمض ضعيف.
مثال:
ملح KF ينتج من تفاعل القاعدة القوية KOH مع الحمض الضعيف HF . (تفاعل إحلال مزدوج)
HF (aq) + KOH (aq) → KF (aq) + H2O (l)
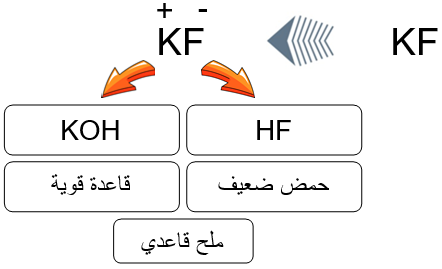
تفسير السلوك القاعدي لملح KF
عند إذابة الملح KF في الماء ينتج أيوني K+ و F-
KF K+ (aq) + F- (aq)
- الأيون F- قاعدة مرافقة قوية لحمض ضعيف (HF) له القدرة على الارتباط مع البروتون، فيتفاعل مع الماء، وينتج أيونات OH- .
F- + H2O HF + OH-
- الأيون K+ مصدره القاعدة القوية (KOH) ليس له القدرة على التفاعل مع الماء، فلا ينتج أيونات H3O+ أو OH- .
وعليه فإن الملح KF قاعدي يزيد من تركيز OH- في المحلول، فتزداد قيمة pH عند إذابته في الماء، ويعد ذوبانه في الماء تميهاً.
الأملاح الحمضية
تنتج الأملاح الحمضية من تفاعل حمض قوي مع قاعدة ضعيفة.
مثال:
ملح NH4Cl ينتج من تفاعل الحمض القوي HCl مع القاعدة الضعيفة NH3 . (تفاعل منح واستقبال بروتون)
NH3 (aq) + HCl (aq) → NH4Cl (aq)
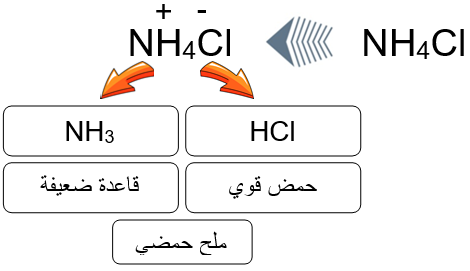
تفسير السلوك الحمضي لملح NH4Cl
عند إذابة الملح NH4Cl في الماء ينتج أيوني NH4+ و Cl-
NH4Cl NH4+ (aq) + Cl- (aq)
- الأيون Cl- قاعدة مرافقة ضعيفة لحمض قوي (HCl) ليس له القدرة على التفاعل مع الماء، فلا ينتج أيونات H3O+ أو OH- .
- الأيون NH4+ مصدره القاعدة الضعيفة (NH3) له القدرة على منح بروتون للماء، فينتج أيونات H3O+ .
NH4+ + H2O NH3 + H3O+
وعليه فإن الملح NH4Cl حمضي يزيد من تركيز H3O+ في المحلول، فتقل قيمة pH عند إذابته في الماء، ويعد ذوبانه في الماء تميهاً.
سؤال (1):
أحدد طبيعة تأثير محلول كل ملح من الأملاح الآتية (حمضي، قاعدي، متعادل):
Na2CO3 , KBr , HCOONa , KF , CH3CH2NH3Br , NaClO4 , NH4Cl
سؤال (2):
أحدد مصدر الأيونات لكل من الأملاح الآتية:
أ- NaOCl
ب- C5H5NHCl
ج- C2H5COOLi
د- KHCO3
هـ- LiOBr
سؤال (3):
أكتب معادلة تفاعل محاليل الحموض والقواعد الآتية، ثم أحدد طبيعة الملح الناتج في كل حالة:
أ- تفاعل محلول الحمض HBr مع محلول القاعدة LiOH .
ب- تفاعل محلول الحمض HI مع محلول القاعدة CH3NH2 .
ج- تفاعل محلول الحمض CH3COOH مع محلول القاعدة KOH .
سؤال (4):
أكتب معادلة تحضير الملح N2H5Cl من N2H4 .
سؤال (5):
أي الأملاح الآتية يُعد ذوبانها في الماء تميهاً: KF , NaClO4 , CH3NH3Br ؟
سؤال (6):
أكتب معادلات تفسّر السلوك الحمضي أو القاعدي أو المتعادل لكل من الأملاح الآتية:
NaCN ، N2H5NO3 ، LiCl .
ملاحظة:
- يمكن الحصول على ملح الحمض باستبدال أيون موجب بأيون الهيدروجين.
مثال: يشتق من حمض HCl الأملاح: NH4Cl , NaCl , KCl وغيرها.
- يمكن الحصول على ملح القاعدة باستبدال أيون سالب بأيون الهيدروكسيد.
مثال: يشتق من القاعدة NaOH الأملاح: NaF , NaCl , NaNO3 وغيرها.
هل هنالك علاقة بين حمضية الحمض وحمضية ملحه؟
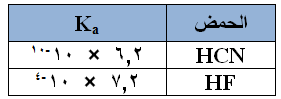 نعم، فلو كان لديك الحمضين HCN ، HF وقيمة ثابت تأينهما كما هو في الجدول المجاور:
نعم، فلو كان لديك الحمضين HCN ، HF وقيمة ثابت تأينهما كما هو في الجدول المجاور:
فأي الملحين أكثر حمضية NaCN أم NaF ؟
لاحظ أن الملحين نتجا من قاعدة قوية (NaOH) وحمضان ضعيفان هما على التوالي (HCN) و (HF)، فالملحان قاعديان، وبما أنهما نتجا من القاعدة نفسها، فلا تأثير لتلك القاعدة على حمضية الملح، ولكنهما نتجا من حمضين مختلفين في القوة، فالحمض HF أقوى من الحمض HCN ، لذا فإن حمضية الملح NaF أعلى، وقيمة pH له أقل.
سؤال (7):
يبين الجدول التالي قيم Ka لثلاثة حموض ضعيفة:
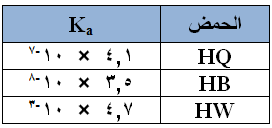
إذا كان لديك محاليل متساوية التركيز من أملاح البوتاسيوم لهذه الحموض. رتب هذه المحاليل وفق زيادة قيمة pH .
سؤال (8):
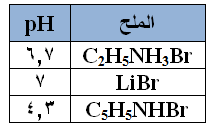 يبين الجدول المجاور قيم pH لثلاثة محاليل لأملاح متساوية في التركيز:
يبين الجدول المجاور قيم pH لثلاثة محاليل لأملاح متساوية في التركيز:
1- رتب محاليل القواعد: C5H5N , LiOH , C2H5NH2 حسب قوتها.
2- أي القاعدتين: C2H5NH2 , C5H5N تمتلك قيمة Kb أعلى؟
هل يمتلك ملح ما قدرة على التميه أكبر من غيره من الأملاح؟
نعم، فالملح ينتج حمض أو قاعدة أضعف أكثر قدرةً على التميه.
مثال:
إذا كانت قيمة Ka للحمض HF = 6.8 x 10-4 ، وللحمض HNO2 = 4.5 x 10-4
فإن الملح NaNO2 أكثر قدرة على التمية من ملح NaF .
سؤال (9):
يبين الجدول الآتي قيم Ka و Kb التقريبية لعدد من محاليل الحموض والقواعد الضعيفة المتساوية التركيز.
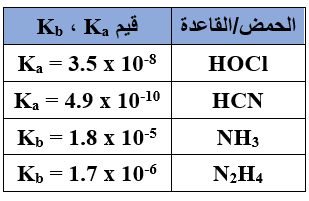
أدرسه ثم أجيب عن الأسئلة الآتية:
1- أي محلولي الملحين: KCN أم KOCl أكثر قدرة على التميه؟
2- أي محلولي الملحين: KCN أم KOCl أقل pH ؟
3- أي محلولي الملحين: NH4Cl أم N2H5Cl أكثر قدرة على التميه؟
4- أي محلولي الملحين: NH4Cl أم N2H5Cl أعلى pH ؟
سؤال (10):
اعتماداً على قيم pH للأملاح المتساوية في التركيز المبينة في الجدول الآتي:
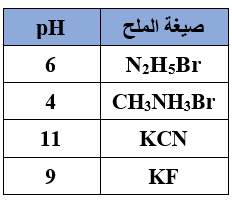
1- أي الملحين القاعديين أكثر قدرة على التميه؟
2- أي الملحين الحمضيين أكثر قدرة على التميه؟
3- ما صيغة الحمض في الملحين القاعديين الذي يمتلك قيمة Ka أعلى؟
4- ما صيغة القاعدة في الملحين الحمضيين الذي يمتلك قيمة Kb أعلى؟
سؤال (11):
لديك محاليل بتركيز 0.1M لكل من: CH3COONa ، NaCl ، NH4Cl ، HCl ، NaOH .
أرتب المحاليل السابقة تصاعدياً تبعاً لرقمها الهيدروجيني pH .
إعداد : شبكة منهاجي التعليمية
31 / 01 / 2023
النقاشات