القواعد
Bases
تتميز القواعد بملمسها الزلق، وبطعمها المر، ولكن من الخطر تذوقها أو شمها؛ لأنها كاوية وحارقة للجلد والأنسجة.
الجدول التالي يمثل أسماء بعض القواعد وصيغها الكيميائية:
|
القاعدة |
الصيغة الكيميائية |
|
هيدروكسيد الصوديوم |
NaOH |
|
هيدروكسيد الكالسيوم |
Ca(OH)2 |
|
هيدروكسيد البوتاسيوم |
KOH |
مفهوم القواعد
القواعد: مواد تُنتج أيونات الهيدروكسيد OH- عند ذوبانها في الماء.
تحتوي أغلب القواعد على مجموعة هيدروكسيد (OH-)؛ لذا عند تأين القاعدة في الماء ينتج أيون (OH-).
مثال (1):
هيدروكسيد الصوديوم NaOH يحتوي على مجموعة هيدروكسيد، وتكتب معادلة تأينه في الماء كالآتي:
NaOH(s) Na+(aq) + OH-(aq)
ويعبر عن تفكك القاعدة NaOH بسهم باتجاه واحد دلاله على كونها قاعدةً قويةً.
مثال (2):
هيدروكسيد الكالسيوم Ca(OH)2 يحتوي على مجموعة هيدروكسيد، وتكتب معادلة تأينه في الماء كالآتي:
Ca(OH)2(s) Ca2+(aq) + 2OH-(aq)
ويعبر عن تفكك القاعدتين NaOH و Ca(OH)2 بسهم باتجاه واحد دلاله على كونهما قواعد قوية.
إلا أن هنالك مواداً لا تحتوي على هيدروكسيد، ولكنها تمتلك صفات القواعد، ومن أمثلتها أكاسيد الفلزات.
مثال:
يعتبر أكسيد الصوديوم (N2O) أكسيداً قاعدياً؛ لأنه عند إذابته في الماء ينتج قاعدة هي هيدروكسيد الصوديوم (NaOH) كما في المعادلة الآتية:
Na2O(s) + H2O(l) 2NaOH(aq)
ويتأين هيدروكسيد الصوديوم في الماء منتجاً أيون (OH-) كما في المعادلة الآتية:
NaOH(s) Na+(aq) + OH-(aq)
وتعرف أكاسيد وهيدروكسيدات الفلزات بالقلويات.
أمثلة على القويات:
- أكسيد الصوديوم Na2O وهيدروكسيد الصوديوم NaOH .
- أكسيد البوتاسيوم K2O وهيدروكسيد البوتاسيوم KOH .
- أكسيد الباريوم BaO وهيدروكسيد الباريوم Ba(OH)2 .
ومن المواد الأخرى التي تعتبر من القواعد ولا تحتوي على أيون الهيدروكسيد مثل الأمونيا NH3 ، ولكن عند تفاعلها مع الماء تنتج أيون الهيدروكسيد كما في المعادلة الآتية:
NH3(g) + H2O(l) ⇔ NH4+(aq) + OH-(aq)
ويعبر عن تفكك NH3 بسهمين متعاكسين دلاله على كونها قاعدةً ضعيفةً.
خصائص القواعد
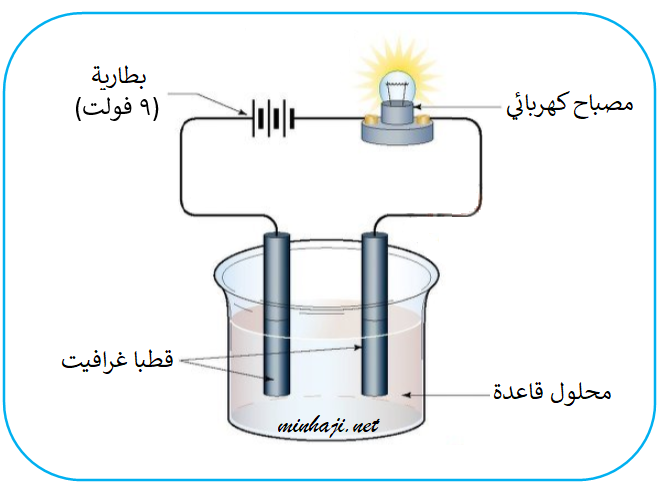
(1) توصيل محاليل القواعد للتيار الكهربائي
توصل محاليل القواعد التيار الكهربائي؛ لأنها تتأين في الماء وتنتج أيونات هيدروكسيد سالبة وأيونات أخرى موجبة حرة الحركة.
مثال:
يتأين هيدروكسيد الباريوم Ba(OH)2 في الماء منتجاً أيون الهيدروكسيد (OH-)، وأيون الباريوم (Ba2+)، كما في المعادلة الآتية:
Ba(OH)2(s) Ba2+(aq) + 2OH-(aq)
(2) تغيير محاليل القواعد لألوان الكواشف
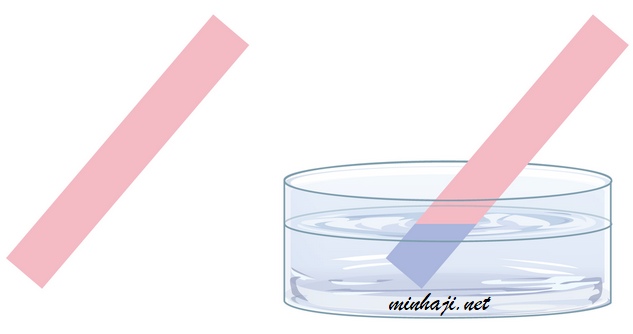
مثال (1):
تغير محاليل القواعد لون ورقة أو محلول تباع الشمس إلى اللون الأزرق.
مثال (2):
تغير محاليل القواعد لون محلول الفينولفثالين من عديم اللون إلى اللون الزهري.
إعداد : شبكة منهاجي التعليمية
13 / 10 / 2024
النقاشات