أولاً: الحموض
Acids
يوجد في بعض المواد الغذائية مواد تكسبها الطعم الحامضي (اللاذع) تُعرف بالحموض.
أمثلة:
نشعر بالطعم الحامضي عند تذوق الليمون والحمضيات، واللبن، والخل؛ لوجود مواد فيها تُعرف بالحموض.

ويمكن تحضير الحموض في المختبرات والمصانع، ولكن من الخطر تذوقها أو شمها؛ لأنها حارقة للجلد والأنسجة، كما أن بعضها سام.
الجدول التالي يمثل أسماء بعض الحموض وصيغها الكيميائية:
|
الحمض |
الصيغة الكيميائية |
|
حمض الهيدروكلوريك |
HCl |
|
حمض النيتريك |
HNO3 |
|
حمض الكبريتيك |
H2SO4 |
مفهوم الحموض
الحموض: مواد تُنتج أيونات الهيدروجين H+ عند ذوبانها في الماء.
تحتوي أغلب الحموض على ذرة هيدروجين؛ لذا عند تأين الحمض في الماء ينتج أيون (H+).
مثال:
حمض الهيدروكلوريك HCl يحتوي على ذرة هيدروجين، وتكتب معادلة تأينه في الماء كالآتي:
HCl(aq) → H+(aq) + Cl-(aq)
ويعبر عن تفكك حمض HCl بسهم باتجاه واحد دلاله على كونه حمضاً قوياً.
إلا أن هنالك مواداً لا تحتوي على هيدروجين، ولكنها تمتلك صفات الحموض، ومن أمثلتها أكاسيد اللافلزات.
مثال:
يعتبر غاز ثاني أكسيد الكربون (CO2) أكسيداً حمضياً؛ لأنه عند إذابته في الماء ينتج حمضاً هو حمض الكربونيك (H2CO3) كما في المعادلة الآتية:
CO2(g) + H2O(l) → H2CO3(aq)
وهذا الحمض يتأين في الماء منتجاً أيون (H+) كما في المعادلة الآتية:
H2CO3(aq) H+(aq) + HCO3-(aq)
ويعبر عن تفكك حمض H2CO3 بسهمين متعاكسين دلاله على كونه حمضاً ضعيفاً.
خصائص الحموض
(1) توصيل محاليل الحموض للتيار الكهربائي
توصل محاليل الحموض التيار الكهربائي؛ لأنها تتأين في الماء وتنتج أيونات هيدروجين موجبة وأيونات أخرى سالبة حرة الحركة.
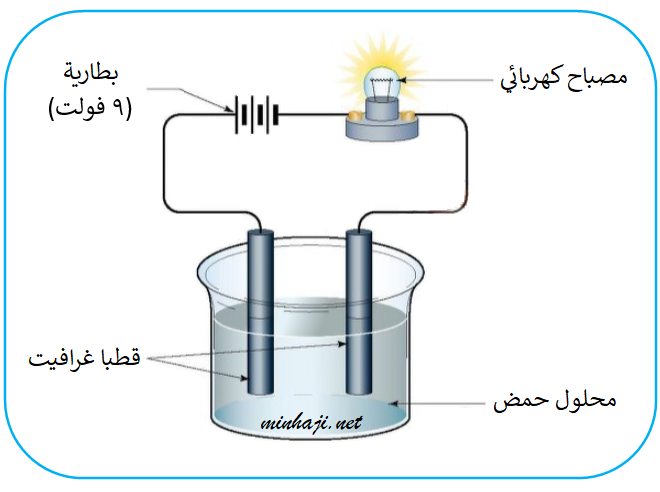
مثال:
يتأين حمض النيتريك HNO3 في الماء منتجاً أيون الهيدروجين (H+)، وأيون النترات (NO3-)، كما في المعادلة الآتية:
HNO3(aq) → H+(aq) + NO3-(aq)
(2) تفاعل محاليل الحموض مع الفلزات
تتفاعل محاليل الحموض مع بعض الفلزات فتحل ذرة الفلز حل ذرة الهيدروجين في الحمض ويتحرر من الحمض غاز الهيدروجين (H2).
مثال:
تفاعل حمض الهيدروكلوريك HCl مع فلز المغنيسيوم (Mg):
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
(3) تغيير محاليل الحموض لألوان الكواشف
مثال (1):
تغير محاليل الحموض لون ورقة أو محلول تباع الشمس إلى اللون الأحمر.

مثال (2):
تغير محاليل الحموض لون محلول الفينولفثالين من اللون الزهري إلى عديم اللون.
إعداد : أ. أحمد الحسين
13 / 10 / 2024
النقاشات