أسئلة المحتوى وإجاباتها
تركيز المحاليل
أتحقق صفحة (73):
أحسب الكسر المولي لكل من الماء وحمض الهيدروكلوريك في محلول منهما، علماً أنّ عدد مولات الماء 2 mol وعدد مولات حمض الهيدروكلوريك 2.5 mol
تحليل السؤال (المعطيات)
عدد مولات حمض الهيدروكلوريك = 2.5 mol
عدد مولات الماء = 2 mol
الحل:
XH2O = = 0.44
XHCl = = 0.56
أتحقق صفحة (75):
أحسب النسبة المئوية بالكتلة للمحلول الناتج من إذابة 70 g من نترات البوتاسيوم في 230 g الماء المقطر.
تحليل السؤال (المعطيات)
كتلة المذاب (solute) = 70 g
كتلة المذيب (solvent) = 230 g
الحل:
m solution = m (solute) + m (solvent) = 70 g + 230 g = 300 g
m% = x 100%
m% = 23.33%
أفكر صفحة (76):
ما الفرق بين النسبة المئوية بالكتلة والنسبة المئوية بالحجم؟
|
الكتلة % |
كتلة المذاب مقسوماً على كتلة المحلول |
المذاب في الحالة الصلبة والمذيب في الحالة السائلة |
|
الحجم % |
حجم المذاب مقسوماً على حجم المحلول |
المذاب والمذيب في الحالة السائلة |
أتحقق صفحة (76):
أحسب النسبة المئوية بالحجم لمحلول من الأسيتون حضر بإذابة 28 mL منه في كمية من الماء المقطر حتى أصبح حجم المحلول 150 mL
تحليل السؤال (المعطيات)
حجم المذاب (solute) = 28 mL
حجم المحلول (solution) =150 mL
الحل:
V% = x 100% = 18.67 %
أتحقق صفحة (78):
أحسب كتلة السكر C6H12O6 اللازمة لعمل محلول حجمه 2 L وتركيزه 0.04 M . علماً أنّ الكتلة المولية (C6H12O6) = 180 g/mol
تحليل السؤال (المعطيات)
حجم المحلول = 2 L
التركيز المولاري M = 0.04 M
الكتلة المولية للمذاب Mr = 180 g/mol
الحل:
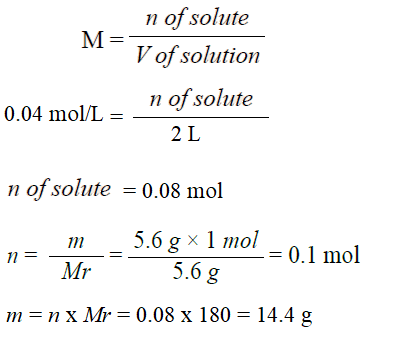
أتحقق صفحة (80):
أحسب مولالية المحلول الذي يحتوي على 8.4 g فلوريد الصوديوم NaF مذابة في 400 g من الماء المقطر. علماً أن الكتلة المولية (NaF) Mr = 42 g/mol
تحليل السؤال (المعطيات)
كتلة المذاب (فلوريد الصوديوم) = 8.4 g
كتلة المذيب (الماء) = 400 g
الحل:
أحسب أولاً عدد مولات المذاب (n):
n = = = 0.2 mol
أحسب مولالية المحلول:
m =
m = = 0.5 m
أتحقق صفحة (83):
أحسب حجم الماء اللازم إضافته إلى 50 mL من محلول KCl الذي تركيزه 4 M ليصبح تركيزه 0.2 M
تحليل السؤال (المعطيات)
M1 = 4 M
M2 = 0.2 M
V1 = 50 mL
?? V2 =
الحل:
M1 x V1 = M2 x V2
4 x 50 = 0.2 x V2
V2 = 1000 mL
حجم الماء المضاف = 1000 – 50 = 950 mL
إعداد : شبكة منهاجي التعليمية
02 / 11 / 2024
النقاشات