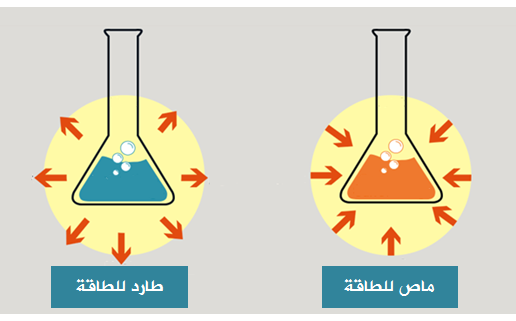
التفاعلات الماصة والطاردة للطاقة
ترافق حدوث التفاعلات الكيميائية تغيرات في الطاقة.
تقسم التفاعلات حسب تغيرات الطاقة إلى قسمين، هما:
1- تفاعلات ماصة للطاقة.
وهي التفاعلات التي تحتاج إلى طاقة كي تحدث.
أمثلة:
- طهو الطعام.
- تفاعلات البناء الضوئي.
- تفاعلات التحلل، كتحلل كربونات الكالسيوم (CaCO3).
2- تفاعلات طاردة للطاقة.
وهي التفاعلات التي تنتج طاقة عند حدوثها.
أمثلة:
- احتراق الوقود.
- احتراق سكر الجلوكوز في الخلايا.
- تفاعلات التعادل بين الحموض والقواعد.
- تفاعل المغنيسيوم مع حمض الهيدروكلوريك.
- تفاعل الثيرمايت الذي يستخدم في لحام سكك الحديد.
التغير في المحتوى الحراري (الإنثالبي)
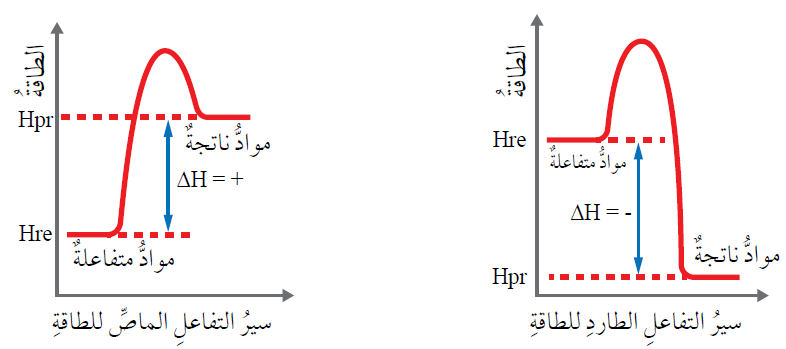
يوجد طاقة مخزنة في المول الواحد من المتفاعلات تُسمى المحتوى الحراري للمتفاعلات، ويرمز لها بالرمز (Hre).
ويوجد طاقة مخزنة في المول الواحد من النواتج تُسمى المحتوى الحراري للنواتج، ويرمز لها بالرمز (Hpr).
وعند طرح المحتوى الحراري للمتفاعلات من المحتوى الحراري للنواتج تُسمى الطاقة المحسوبة التغير في المحتوى الحراري (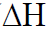 ).
).
العلاقة الآتية يحسب من خلالها التغير في المحتوى الحراري:

تكون إشارة التغير في المحتوى الحراري للتفاعل موجبة (+) إذا كان المحتوى الحراري للنواتج أكبر من المحتوى الحراري للمتفاعلات، ويكون التفاعل ماصاً للطاقة.
تكون إشارة التغير في المحتوى الحراري للتفاعل سالبة (-) إذا كان المحتوى الحراري للنواتج أقل من المحتوى الحراري للمتفاعلات، ويكون التفاعل طارداً للطاقة.
إعداد : شبكة منهاجي التعليمية
10 / 04 / 2022
النقاشات