أسئلة إضافية
نظرية بور لذرة الهيدروجين
السؤال الأول:
أكتب بين القوسين المصطلح العلمي الذي يعبر عن كل من:
- ( ) عدد القمم التي تمر بنقطة خلال ثانية.
- ( ) مجموعة الأمواج الضوئية التي تصدر عن ذرات العناصر، ويقع بعضها في منطقة الضوء المرئي، وبعضها الآخر في منطقة الضوء غير المرئي.
- ( ) مجموعة من الأطوال الموجية للضوء الصادر عن ذرات العنصر المثارة عند عودة الإلكترون إلى حالة الاستقرار.
- ( ) جميع الأطوال الموجية التي يتكون منها الضوء.
- ( ) جسيمات مادية متناهية في الصغر تُمثّل الوحدات الأساسية المكونة للضوء، ويحمل كل منها مقداراً مُحدداً من الطاقة. وهي تعبر عن الطبيعة المزدوجة (مادية-موجية) للضوء.
السؤال الثاني:
الشكل الآتي يمثّل مستويات الطاقة في ذرة الهيدروجين. أدرسه جيداً، ثم أجيب عمّا يليه من أسئلة:
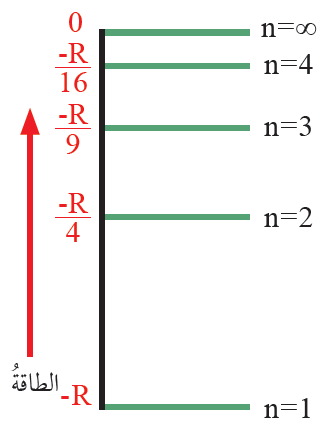
أ- أعبّر بدلالة R عن مقدار الطاقة المنبعثة عند عودة الإلكترون من المستوى الرابع إلى المستوى الثالث.
ب- أحدّد المستويين المتتاليين اللذين ينتقل بينهما الإلكترون ليعطي طيفاً له أعلى طاقة.
السؤال الثالث:
أحسب الطاقة التي تحتاج إليها ذرة الهيدروجين المستقرّة لكي تتحوّل إلى الأيون +H.
السؤال الرابع:
أحدد رمز الإجابة الصحيحة في الفقرات التالية:
(1) إحدى الأمواج الكهرومغناطيسية التالية لها أقل طول موجي، وهي:
(أ) أشعة X.
(ب) الأشعة تحت الحمراء.
(ج) أمواج الراديو.
(د) الأشعة فوق البنفسجية.
(2) واحدة من الأطوال الموجية الآتية (بوحدة النانومتر) لموجة كهرومغناطيسية تقع في منطقة الطيف المرئي، وهي:
(أ) 410
(ب) 870
(ج) 300
(د) 230
(3) يقاس تردد الضوء بوحدة:
(أ) cm
(ب) m
(ج) j.s
(د) Hz
(4) تردد الضوء يتناسب:
(أ) عكسياً مع طول موجته.
(ب) طردياً مع سرعة الضوء.
(ج) عكسياً مع طاقته.
(د) عكسياً مع سرعة الضوء.
(5) العلاقة 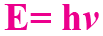 تُعرف بعلاقة:
تُعرف بعلاقة:
(أ) أينشتاين.
(ب) بور.
(ج) بلانك.
(د) رذرفورد.
(6) الطيف الذري للعنصر ينتج عن:
(أ) دوران الإلكترون حول نفسه.
(ب) دوران الإلكترون حول النواة.
(ج) حركة الإلكترون الموجية.
(د) سقوط الإلكترون إلى مستوى طاقة أقل.
(7) إحدى العبارات التالية تتفق والطيف الذري، وهي:
(أ) لجميع العناصر الطيف الذري نفسه.
(ب) يتألف من عدة خطوط ملونة منفصلة.
(ج) ينتج عن انتقال الإلكترون إلى مستوى طاقة أعلى.
(د) ينتج من تحليل ضوء مصباح كهربائي.
(8) طاقة المستوى الثاني في ذرة الهيدروجين بدلالة R تساوي:
(أ) 2R
(ب) -2R
(ج) -0.25R
(د) -0.5R
(9) إذا كانت طاقة أحد المستويات في ذرة الهيدروجين تساوي -0.04R فإن رقم ذلك المستوى هو:
(أ) 2
(ب) 3
(ج) 4
(د) 5
(10) طاقة المستوى اللانهائي في ذرة الهيدروجين تساوي:
(أ) R
(ب) -R
(ج) 0
(د) ¥
(11) أعلى طاقة يبعثها الإلكترون في ذرة الهيدروجين عند انتقاله من مستوى الطاقة الرئيس:
(أ) الخامس للرابع.
(ب) الرابع للثالث.
(ج) الثالث للثاني.
(د) الثاني للأول.
السؤال الخامس:
إذا كانت طاقة أحد المستويات في ذرة الهيدروجين تساوي -5,45 × 10-19جول، فاحسب رقم ذلك المستوى. علماً بأن ثابت رايدبيرغ يساوي -2,18 ×10-18جول.
السؤال السادس:
إذا كان تردد الضوء يساوي 6,5 × 1410 Hz ، فاحسب كلاً من:
- طاقة فوتون الضوء بالجول.
- طول الموجه بالمتر.
(اعتبر أن ثابت بلانك = 6.6 × 10-34 جول . ث ، سرعة الضوء = 3 × 810 م/ث)
السؤال السابع:
أحسب الطاقة (بالجول/ذرة) الناتجة عن انتقال الإلكترون في ذرة الهيدروجين من المستوى الثالث إلى المستوى الأول. ثابت رايدبيرغ = 2.18 ×10-18 جول .
السؤال الثامن:
ما قيمة الطاقة (بالجول) المنبعثة من إلكترون انتقل من المستوى رقم (6) إلى المستوى رقم (1) في ذرة الهيدروجين . إذا علمت أن ثابت رايدبيرغ= 2.18 × 10-18 جول .
السؤال التاسع:
أحسب الطاقة (بالجول) اللازمة لتحويل ذرة هيدروجين مستقرة إلى الأيون H+ ، إذا علمت أن ثابت رايدبيرغ = 2.18 × 10-18 جول.
السؤال العاشر:
احسب الطاقة اللازمة لتهييج ذرة هيدروجين مستقرة للمستوى الرابع بدلالة R .
السؤال الحادي عشر:
احسب مقدار الطاقة المنبعثة عند عودة الإلكترون في ذرة الهيدروجين من المستوى الخامس إلى المستوى الثاني ( بدلالة الثابت R ) .
السؤال الثاني عشر:
احسب تردد الضوء المنبعث عند عودة الإلكترون في ذرة الهيدروجين من المستوى الرابع إلى المستوى الثاني ( R = 2.2 × 10-18 جول ، ثابت بلانك = 6.6 × 10-34 جول.ث ) .
إعداد : شبكة منهاجي التعليمية
01 / 09 / 2023
النقاشات