تفاعلات الفلزات مع الأكسجين والماء
الفلزات عناصر تقع في يسار الجدول الدوري ووسطه.
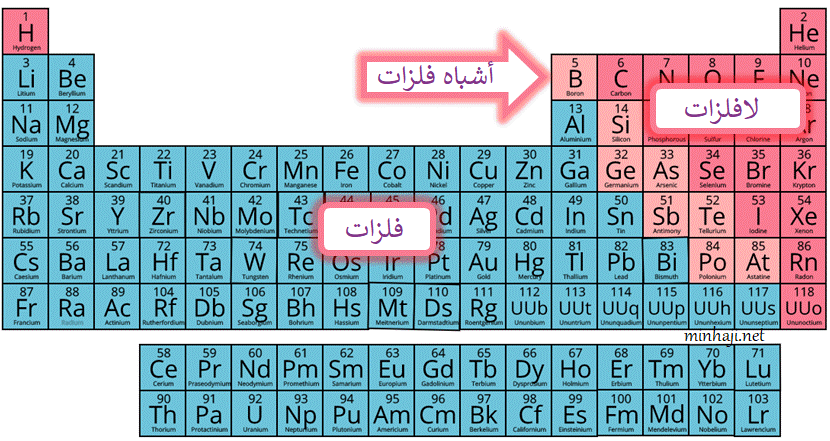
خصائص الفلزات
- لامعة.
- صلبة عند درجة حرارة الغرفة.
- موصلة للتيار الكهربائي والحرارة.
- قابلة للسحب والطرق.
تفاعل الفلزات مع الأكسجين
تتفاعل الفلزات مع الأكسجين (الهواء الجوي) وينتج من تفاعلهما أكسيد الفلز، وعند تعرض الفلز للأكسجين يقل لمعانه.
يعبر عن التفاعل بالمعادلة اللفظية الآتية:
فلز + أكسجين ← أكسيد الفلز
تتفاوت الفلزات في شدة تفاعلها مع الأكسجين:
- فبعضها تتفاعل بسرعة معه، مثل: الليثيوم، والصوديوم، والبوتاسيوم.
- وبعض الفلزات تتفاعل بسرعة أقل مع الأكسجين، مثل: الخارصين ، والكالسيوم.
- وهنالك فلزات تتفاعل ببطء شديد مع الأكسجين، مثل: النحاس، والنيكل، والحديد.
مثال (1):
يتفاعل الصوديوم بشدة مع الأكسجين (الهواء الجوي)، وينتج أكسيد الصوديوم.
المعادلة اللفظية:
صوديوم + أكسجين ← أكسيد الصوديوم
المعادلة الرمزية الموزونة:
4Na (s) + O2 (g) → 2Na2O (s)
ويحدث هذا التفاعل بمجرد تعرض الصوديوم للهواء، فيتغير لون الصوديوم الفضي اللامع خلال دقائق، وتتكون طبقة هشة رمادية من أكسيد الصوديوم على سطحه.
مثال (2):
يتفاعل الألمنيوم ببطء مع الأكسجين (الهواء الجوي)، وينتج أكسيد الألمنيوم.
المعادلة اللفظية:
ألمنيوم + أكسجين ← أكسيد الألمنيوم
المعادلة الرمزية الموزونة:
4Al (s) + 3O2 (g) → 2Al2O3 (s)
عند تعرض الألمنيوم للهواء، تتكون على سطحة طبقة من أكسيد الألمنيوم تغطي سطحه فتحميه من المواد الموجودة في الهواء؛ لذا يستخدم الألمنيوم في صناعة النوافذ والأبواب.
مثال (3):
يتفاعل الحديد ببطء شديد مع الأكسجين (الهواء الجوي)، وينتج أكسيد الحديد.
المعادلة اللفظية:
حديد + أكسجين ← أكسيد الحديد
عند تعرض الحديد للهواء والرطوبة، تتكون على سطحة طبقة هشة بنية من أكسيد الحديد، وتعرف هذه المادة بصدأ الحديد.
تفاعل الفلزات مع الماء
تتفاعل الفلزات مع الماء وينتج من تفاعلهما هيدروكسيد الفلز وغاز الهيدروجين.
ويعتبر هيدروكسيد الفلز مادة قاعدية، ذات ملمس صابوني، تغير لون ورقة تباع الشمس إلى اللون الأزرق.
يعبر عن التفاعل بالمعادلة اللفظية الآتية:
فلز + ماء ← هيدروكسيد الفلز + غاز الهيدروجين
تتفاوت الفلزات في شدة تفاعلها مع الماء:
- فبعضها تتفاعل بشدة مع الماء، مثل: الليثيوم، والصوديوم، والبوتاسيوم.
- وبعض الفلزات تتفاعل بشدة أقل مع الماء، وتحتاج لتسخين لتتفاعل، مثل: الخارصين، والكالسيوم.
- وهنالك فلزات تتفاعل ببطء شديد مع الماء الساخن، مثل: النحاس، والرصاص.
مثال (1):
يتفاعل البوتاسيوم بشدة مع الماء، وينتج هيدروكسيد البوتاسيوم وغاز الهيدروجين.
المعادلة اللفظية:
بوتاسيوم + ماء ← هيدروكسيد البوتاسيوم + غاز الهيدروجين
المعادلة الرمزية الموزونة:
2K (s) + H2O (l) → 2KOH (aq) + H2 (g)
مثال (2):
يتفاعل الليثيوم بشدة مع الماء، وينتج هيدروكسيد الليثيوم وغاز الهيدروجين.
المعادلة اللفظية:
ليثيوم + ماء ← هيدروكسيد الليثيوم + غاز الهيدروجين
المعادلة الرمزية الموزونة:
2Li (s) + H2O (l) → 2LiOH (aq) + H2 (g)
إعداد : شبكة منهاجي التعليمية
30 / 03 / 2022
النقاشات