 |
أسئلة المحتوى وإجاباتها
أفكر صفحة (60):
أكتب معادلة التفاعل؛ إذا كان تعبير ثابت الاتزان لخليط من الغازات في وعاء تفاعل هو:
= Kc
2NOCl 2NO + Cl2
أتحقق صفحة (61):
أ- أكتب تعبير ثابت الاتزان بدلالة تراكيز المواد لكل من التفاعلات الآتية:
1- FeO (s) + CO (g) Fe (s) + CO2 (g)
Kc =
2- ZnCO3 (s) ZnO (s) + CO2 (g)
Kc = [CO2]
3- Cr2O72- (aq) + H2O (l) 2CrO42- (aq) + 2H+ (aq)
Kc =
ب- أكتب تعبير ثابت الاتزان بدلالة الضغط الجزئي للغازات في كل من التفاعلات الآتية:
1- CO (g) + 3H2 (g) CH4 (g) + H2O (g)
Kp =
2- 2AsH3 (g) 2As (s) + 3H2 (g)
Kp =
3- CuO (s) + H2 (g) Cu (l) + H2O (g)
Kp =
أفكر صفحة (65):
يبين الشكل النتائج التجريبية لإحدى التجارب، ويمثل أحد المنحنيين المادة A ، ويمثل الآخر المادة B . أحسب ثابت الاتزان.
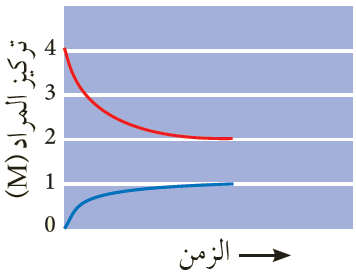
Kc = = = 0.5
أتحقق صفحة (65):
أحسب ثابت الاتزان لتحلل غاز الفوسجين COCl2 في وعاء مغلق حجمه 0.4 L كما في المعادلة الآتية:
COCl2 (g) CO (g) + Cl2 (g)
إذا كان عدد مولات الغازات في وعاء التفاعل عند الاتزان كما يأتي:
CO = 0.071 mol , Cl2 = 0.071 mol , COCl2 = 3 mol
تحليل السؤال (المعطيات):
عدد مولات CO = 0.071 mol ، عدد مولات C = 0.071 mol
عدد مولات COCl2 = 3 mol
حجم خليط الغازات = 0.4 L
الحل:
أحسب تراكيز المتفاعلات والنواتج عند الاتزان:
n CO = = 0.1775 M 0.18 M
n Cl2 = = 0.1775 M 0.18 M
n COCl2 = = 7.5 M
Kc = = = 4.32 x 10-3