المعادلة الأيونية
Ionic Equation
يعبر عن التفاعل الكيميائي بمعادلة كيميائية موزونة، تظهر فيها المتفاعلات والنواتج، وكمياتها، وحالتها الفيزيائية، وظروف التفاعل.
إلا أن المعادلة الكيميائية التي تحدث في المحاليل المائية لا توضح الأيونات الموجبة والسالبة في محاليل المركبات الأيونية؛ لذا استخدم الكيميائيون المعادلة الأيونية التي تبين الجسيمات الموجودة في المحلول، وبحذف الأيونات المتفرجة؛ والتي لا تشترك في التفاعل ينتج المعادلة الأيونية النهائية (الصافية)؛ والتي تظهر فيها الأيونات المتفاعلة فقط.
مثال (1):
يتفاعل محلول نترات الرصاص Pb(NO3)2 مع محلول يوديد البوتاسيوم KI ، وينتج من تفاعلهما محلول نترات البوتاسيوم KNO3 ، ويترسب يوديد الرصاص PbI ، وفق المعادلة الآتية:
Pb(NO3)2 (aq) + 2KI (aq) → 2KNO3 (aq) + PbI2 (aq)
ويعبر عن التفاعل السابق بالمعادلة الأيونية الآتية:
Pb2+(aq) + 2NO3-(aq) + 2K+(aq) + 2I-(aq) → PbI2 (s) + 2K+(aq) + 2NO3-(aq)
وبشطب الأيونات المتفرجة:
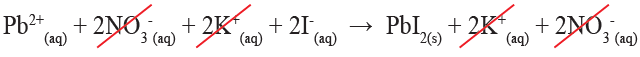
تكتب المعادلة الأيونية الصافية على النحو الآتي:
Pb2+(aq) + 2I- (aq) → PbI2 (s)
مثال (2):
يترسب كلوريد الفضة عند مزج محلولي نترات الفضة وكلوريد الصوديوم وفق المعادلة الآتية:
AgNO3 (aq) + NaCl (aq) → AgCl (s) + NaNO3 (aq)
ويعبر عن التفاعل السابق بالمعادلة الأيونية الآتية:
Ag+(aq) + NO3-(aq) + Na+(aq) + Cl-(aq) → AgCl (s) + Na+(aq) + NO3-(aq)
وبشطب الأيونات المتفرجة، تكتب المعادلة الأيونية الصافية على النحو الآتي:
Ag+ (aq) + Cl- (aq) → AgCl (s)
مثال (3):
يتفاعل محلول كلوريد النحاس CuCl2 (II) مع محلول هيدروكسيد الصوديوم NaOH ؛ ليتكون محلول كلوريد الصوديوم NaCl ، ويترسب هيدروكسيد النحاس Cu(OH)2 (II) ، أكتب المعادلة الأيونية النهائية.
نكتب معادلة التفاعل:
CuCl2 (aq) + 2NaOH (aq) → Cu(OH)2 (s) + 2NaCl (aq)
يعبر عن التفاعل السابق بالمعادلة الأيونية الآتية:
Cu2+(aq) + 2Cl-(aq) + 2Na+(aq) + 2OH-(aq) → Cu(OH)2 (s) + 2Na+(aq) + 2Cl-(aq)
وبشطب الأيونات المتفرجة، تكتب المعادلة الأيونية الصافية على النحو الآتي:
Cu2+(aq) + 2OH- (aq) → Cu(OH)2 (s)
إعداد : أ. أحمد الحسين
19 / 10 / 2024
النقاشات