التأكسد والاختزال الذاتي
Disproportionation Reaction
تفاعل التأكسد والاختزال الذاتي: سلوك المادة كعامل مؤكسد وعامل مختزل في التفاعل نفسه.
مثال (1):
أبين لماذا يعد تفاعل تحلل فوق أكسيد الهيدروجين تفاعل تأكسد واختزال ذاتي.
2H2O2 → 2H2O + O2
الحل:
أحدد أعداد تأكسد لجميع الذرات في التفاعل:
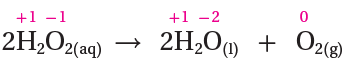
اختزل الأكسجين وقل عدد تأكسده من ( -1 في H2O2 إلى -2 في H2O )، فيكون H2O2 عاملاً مؤكسداً.
تأكسد الأكسجين وزاد عدد تأكسده من ( -1 في H2O2 إلى 0 في O2 )، فيكون H2O2 عاملاً مختزلاً.
التأكسد حصل لنفس العنصر وهو الأكسجين في H2O2 ، وعليه فالتفاعل يمثل تأكسداً واختزالاً ذاتياً.
مثال (2):
يتفاعل الكلور مع هيدروكسيد الصوديوم البارد حسب المعادلة الكيميائية الآتية:
2NaOH (aq) + Cl2 (g) → NaCl (aq) + NaClO (aq) + H2O (l)
أبين لماذا يعد التفاعل أعلاه مثالاً على تفاعلات التأكسد والاختزال الذاتي.
الحل:
أكتب معادلة أيونية للتفاعل:
2Na+1(aq) + OH- (aq) + Cl2 (g) → Na+1 (aq) + Cl-1 (aq) + Na+1 (aq) + ClO-1 (aq) + H2O (l)
وبحذف أيون الصوديوم Na+1 المتفرج، تصبح المعادلة:
OH- (aq) + Cl2 (g) → Cl-1 (aq) + ClO-1 (aq) + H2O (l)
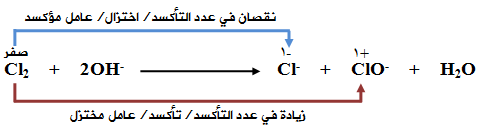
اختزل الكلور وقل عدد تأكسده من ( 0 في Cl2 إلى -1 في Cl- )، فيكون Cl2 عاملاً مؤكسداً.
تأكسد الكلور وزاد عدد تأكسده من ( 0 في Cl2 إلى +1 في ClO- )، فيكون Cl2 عاملاً مختزلاً.
التأكسد حصل لنفس العنصر وهو الكلور في Cl2 ، وعليه فالتفاعل يمثل تأكسداً واختزالاً ذاتياً.
سؤال (1):
أدرس التفاعلات التالية، ثم أجيب عن الأسئلة التي تليها:
A) P4 → PH3 + H2PO2-
B) Se → Se2- + SeO32-
C) Br2 → Br- + BrO3-
1- أبيّن أن التفاعلات السابقة تمثل تفاعلات تأكسد واختزال ذاتي.
2- أحدد التغير في عدد تأكسد كل من الفسفور، والسيلينيوم، والبروم عند تأكسدها؟
إجابات اسئلة الدرس في الملفات المرفقة.
إعداد : شبكة منهاجي التعليمية
11 / 01 / 2023
النقاشات