إجابات أسئلة الفصل
السؤال الأول:
قاعدة أرهينيوس: مادة تزيد من تركيز أيون الهيدروكسيد (OH-) عند إذابتها في الماء.
حمض برونستد - لوري: مادة (جزيئات أو أيونات) قادرة على منح بروتون (مانح للبروتون) لمادةٍ أخرى في التفاعل.
قاعدة لويس: مادة تستطيع أن تمنح زوجاً أو أكثر من الإلكترونات غير الرابطة لمادةٍ أخرى.
الرقم الهيدروجيني: اللوغاريتم السالب للأساس 10 لتركيز أيون الهيدرونيوم H3O+ في المحلول.
السؤال الثاني:
المعادلة الأولى: الحمض (H2O)، القاعدة (PO43-).
المعادلة الثانية: الحمض (HNO3)، القاعدة (H2O).
السؤال الثالث:
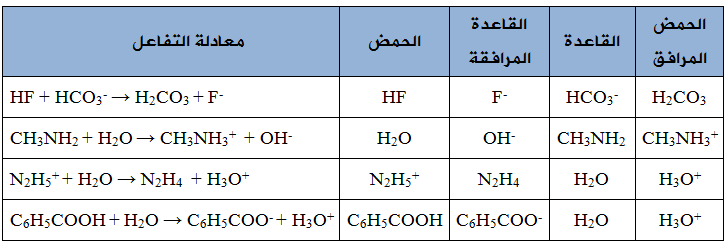
السؤال الرابع:
أ- يسلك الماء في المعادلة الأولى كقاعدة، ويسلك الماء في المعادلة الثانية كحمض.
ب-
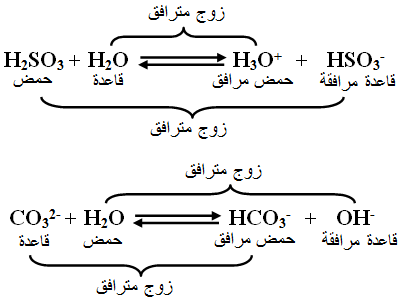
السؤال الخامس:
يعتبر HCN حمضاً حسب مفهوم أرهينيوس لأنه يزيد من تركيز أيونات H+ عند إذابته في الماء.
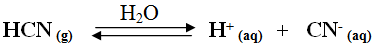
السؤال السادس:
تعتبر الأمونيا قاعدةً حسب مفهوم برونستد - لوري لأنها مستقبلة للبروتون من مادة أخرى كالماء كما في المعادلة:

وتعتبر الأمونيا قاعدةً حسب مفهوم لويس لأنها مانحه لزوج من الإلكترونات غير الرابطة لمادة أخرى كالماء كما في المعادلة:
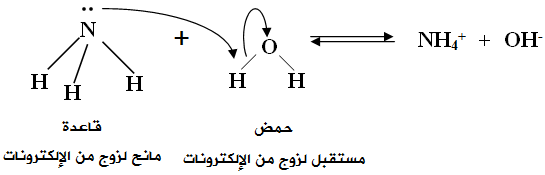
السؤال السابع:
المعادلة الأولى: حمض لويس (Ag+) ، قاعدة لويس (NH3) .
المعادلة الثانية: حمض لويس (Fe3+) ، قاعدة لويس (CN-) .
السؤال الثامن:
أ- محلول قاعدي.
ب- محلول حمضي.
ج- محلول حمضي.
السؤال التاسع:
HCO3- , H2O
السؤال العاشر:
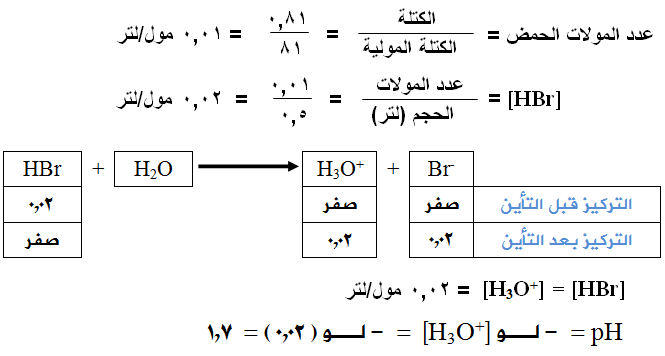
السؤال الحادي عشر:
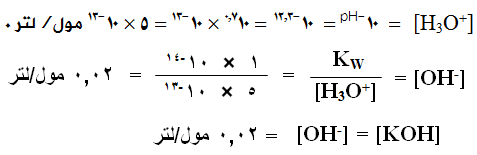
عدد مولات KOH = [KOH] × الحجم (لتر)
عدد مولات KOH = 0,02 × 1 = 0,02 مول
كتلة KOH = عدد مولات KOH × الكتلة المولية
كتلة KOH = 0,02 × 56 = 1,12 غ
إعداد : شبكة منهاجي التعليمية
19 / 07 / 2019
النقاشات