الرابطة الأيونية
Ionic bond
الرابطة الأيونية: هي قوة تجاذب كهربائية ساكنة بين أيون موجب وأيون سالب.
مثال:
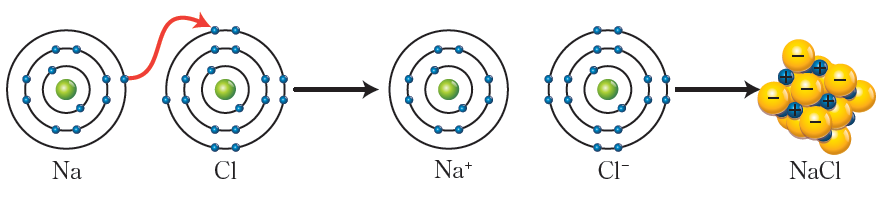
الرابطة الأيونية في كلوريد الصوديوم NaCl (ملح الطعام).
تحتوي ذرة الصوديوم على إلكترون واحد سطحي.
11Na: (2-8-1)
تحتوي ذرة الكلور على 7 إلكترونات سطحية.
17Cl: (2-8-7)
ولكي تصل الذرتان إلى قاعدة الثمانية:
تفقد ذرة الصوديوم إلكترون لتصبح أيون Na+ .
11Na+: (2-8)
تكسب ذرة الكلور إلكترون من الصوديوم لتصبح أيون Cl- .
17Cl-: (2-8-8)
يتجاذب أيون الصوديوم الموجب مع أيون الكلور السالب بتجاذب كهربائي يسمى الرابطة الأيونية.
خصائص المركبات والمواد الأيونية
- جميعها صلبة في الدرجة العادية من الحرارة.
- لا تنقل التيار الكهربائية في حالتها الصلبة (لأن أيوناتها مقيدة الحركة)، ولكن محاليلها ومصاهيرها تنقل التيار الكهربائي (لأن أيوناتها حرة الحركة).
- درجات غليانها وانصهارها مرتفعة.
إعداد : شبكة منهاجي التعليمية
14 / 06 / 2019
النقاشات