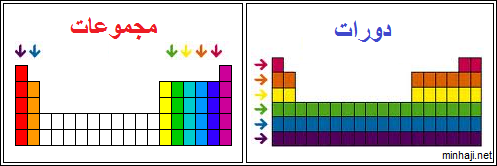
الدورات والمجموعات في الجدول الدوري
تنتظم العناصر في الجدول الدوري ضمن صفوف أفقية تسمى دورات، وعددها سبع دورات.
كما تنتظم ضمن (18) مجموعة عمودية، (8) منها ممثلة والبقية انتقالية.
تحديد رقم دورة العنصر
يمكن تحديد رقم دورة العنصر بحساب عدد مستويات الطاقة التي تشغلها الإلكترونات في التوزيع الإلكتروني للعنصر.
مثال (1):
العدد الذري لليثيوم = 3 وعند رسم التوزيع الإلكتروني لذرته نلاحظ أن الإلكترونات الثلاثة توزعت في مستويي طاقة، لذا نقول أن الليثيوم ينتمي إلى الدورة الثانية، لاحظ من خلال الجدول الدوري أن الليثيوم يقع في السطر الأفقي الثاني.

مثال (2):
العدد الذري للصوديوم = 11 وعند رسم التوزيع الإلكتروني لذرته نلاحظ أن الإلكترونات الـ (11) توزعت على ثلاثة مستويات طاقة، لذا نقول أن الصوديوم ينتمي إلى الدورة الثالثة، لاحظ من خلال الجدول الدوري أن الصوديوم يقع في السطر الأفقي الثالث.

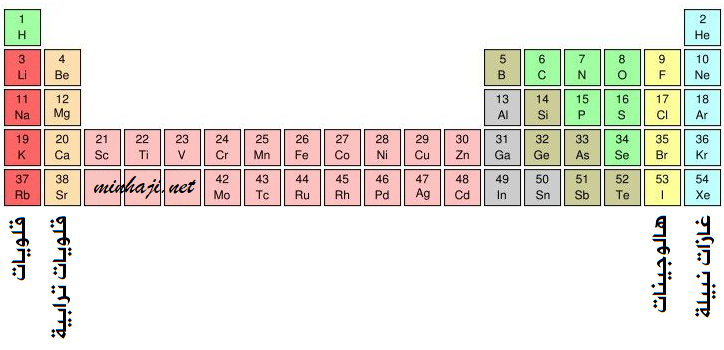
تحديد رقم مجموعة العنصر
يمكن تحديد رقم مجموعة العنصر الممثل من خلال التوزيع الإلكتروني، من خلال عدد الإلكترونات في مستوى الطاقة الخارجي (الأخير) في التوزيع الإلكتروني للعنصر،، وتعرف إلكترونات المستوى الخارجي بإلكترونات التكافؤ.
ولعناصر المجموعة الواحدة العدد نفسه من الإلكترونات في المستوى الخارجي (إلكتروونات التكافؤ).
وتتشابه عناصر المجموعة الواحدة في الخصائص الكيميائية والفيزيائية.
مثال (1):
ينتمي المغنيسيوم للمجموعة الثانية، لأن عدد الإلكترونات في مستوى الطاقة الخارجي (الأخير) في ذرته = (2).
12Mg: 2 , 8 , 2
مثال (2):
ينتمي الكلور للمجموعة السابعة، لأن عدد الإلكترونات في مستوى الطاقة الخارجي (الأخير) في ذرته = (7).
17Cl: 2 , 8 , 7
ولبعض المجموعات أسماء خاصة:
- تُعرف المجموعة الأولى بالقلويات.
- تُعرف المجموعة الثانية بالقلويات الترابية.
- تُعرف المجموعة السابعة بالهالوجينات.
- تُعرف المجموعة الثامنة بالغازات النبيلة.
سؤال:
1- حدد رقم دورة كل عنصرٍ من العناصر الآتية في الجدول الدوري، ومجموعته.
13Al , 8O , 18Ar , 14Si
2- إذا علمت أن الرموز الافتراضية في الجدول الدوري الآتي تمثل عناصر في هذا الجدول، فأجب عمّا يأتي:
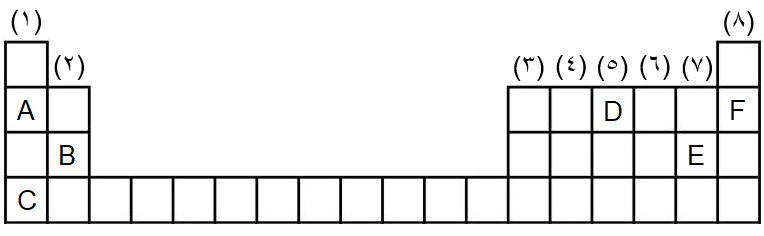
أ- ما رموز العناصر التي توجد في مجموعةٍ واحدةٍ؟ وما رقم هذه المجموعة؟
ب- ما رمز العنصر الذي يقع في الدورة الرابعة؟
ج- ما رمز العنصر الذي ينتمي لمجموعة الغازات النبيلة؟
د- ما رقم مجموعة العنصر الافتراضي (D)؟
هـ- ما رموز العناصر التي تقع في دورةٍ واحدةٍ؟ وما رقم هذه الدورة؟
إجابة السؤال:
1- أرقام الدورات والمجموعات:
الألمنيوم: الدورة الثالثة، المجموعة الثالثة.
الأكسجين: الدورة الثانية، المجموعة السادسة.
الآرغون: الدورة الثالثة، المجموعة الثامنة.
السيليكون: الدورة الثالثة، المجموعة الرابعة.
2- الجدول الدوري:
أ- العنصرين (A) و (C) وينتميان للمجموعة الأولى.
ب- العنصر (C).
ج- العنصر (F).
د- المجموعة الخامسة.
هـ- العناصر (A) و (F) و (D) تنتمي للدورة الثانية، والعنصرين (B) و (E) ينتمان للدورة الثالثة.
الذرة المستقرة
توصف الذرة بأنها مستقرة إذا اكتمل مستوى الطاقة الخارجي بالإلكترونات.
مثال (1):
العدد الذري للهيليوم يساوي (2).
التوزيع الإلكتروني لذرة الهيليوم هو:
2He: 2
ألاحظ أن مستوى الطاقة الخارجي للهيليوم يحتوي على (2) إلكترون، والسعة القصوى من الإلكترونات لمستوى الطاقة الأول يساوي (2)، لذا تكون ذرة الهيليوم مستقرة.
مثال (2):
العدد الذري للنيون يساوي (10).
التوزيع الإلكتروني لذرة النيون هو:
10Ne: 2 , 8
ألاحظ أن مستوى الطاقة الخارجي للنيون يحتوي على (8) إلكترونات، والسعة القصوى من الإلكترونات لمستوى الطاقة الثاني يساوي (8)، لذا تكون ذرة النيون مستقرة.
مجموعات الجدول الدوري
المجموعة الأولى
- تبدأ المجموعة الأولى بعنصر الليثيوم (3Li)، وتحته عنصر الصوديوم (11Na).
- تحتوى ذرات عناصر هذه المجموعة على إلكترون واحد في المستوى الخارجي.
- عناصر المجموعة الأولى فلزات صلبة ونشطة في تفاعلاتها.
- تعرف مجموعة بالقلويات.
المجموعة الثانية
- تبدأ المجموعة الثانية بعنصر البريليوم (4Be)، وتحته عنصر الصوديوم (12Mg).
- تحتوى ذرات عناصر هذه المجموعة على إلكترونين في المستوى الخارجي.
- عناصر المجموعة الثانية فلزات صلبة.
- تعرف مجموعة بالقلويات الترابية.
المجموعة الثالثة
- تبدأ المجموعة الثالثة بعنصر البورون (5B)، وتحته عنصر الألمنيوم (13Al).
- تحتوى ذرات عناصر هذه المجموعة على (3) إلكترونات في المستوى الخارجي.
- عناصر المجموعة الثالثة فلزات صلبة، ما عدا البورون فهو شبه فلز أسود اللون وهش.
المجموعة الرابعة
- تبدأ المجموعة الرابعة بعنصر الكربون (6C)، وتحته عنصر السيليكون (14Si).
- تحتوى ذرات عناصر هذه المجموعة على (4) إلكترونات في المستوى الخارجي.
- عناصر المجموعة الرابعة يمكن أن تكون فلزات، أو لافلزات، أو أشباه فلزات.
إعداد : شبكة منهاجي التعليمية
29 / 08 / 2022
النقاشات
ثامر المراعية
شكرا لك
إضافة رد
0 ردود