الرابطة الأيونية
Ionic Bond
الرابطة الأيونية: قوى جذب كهربائي تنشأ بين ذرتين إحداهما تميل لفقد الإلكترونات وتكوين أيونٍ موجبِ الشحنةِ، والأخرى تميل لفقد الإلكتروناتِ وتكوين أيونٍ سالبِ الشحنةِ.
مثال: كلوريد الصوديوم
يميل الصوديوم (فلز) للارتباط مع الكلور (لافلز) لتكوين كلوريد الصوديوم.
التوزيع الإلكتروني للصوديوم هو:
11Na: 2 , 8 , 1
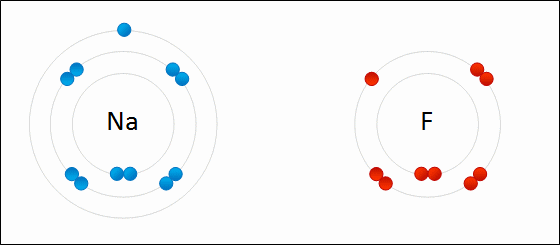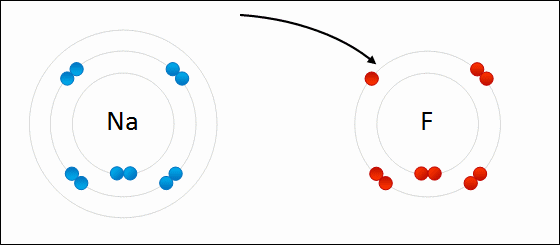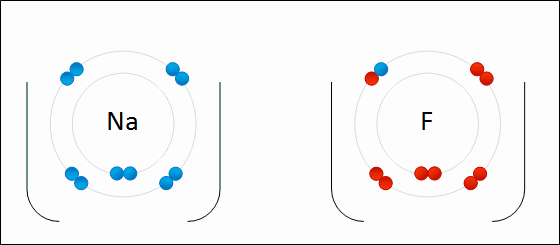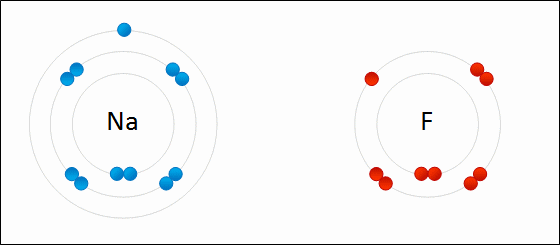
تميل ذرة الصوديوم لفقد إلكترون ليصبح توزيعها الإلكتروني مشابهاً لتوزيع غاز النيون النبيل المستقر، فتصبح بذلك أيوناً موجباً (Na+).
التوزيع الإلكتروني للكلور هو:
17Cl: 2 , 8 , 7
تميل ذرة الكلور لكسب إلكترون ليصبح توزيعها الإلكتروني مشابهاً لتوزيع غاز الآرغون النبيل المستقر، فتصبح بذلك أيوناً سالباً (Cl-).
وعندما يتجاذب أيون الصوديوم الموجب مع أيون الكلور السالب ينتج مركباً أيونياً، وتنشأ بين الأيونين رابطة أيونية.
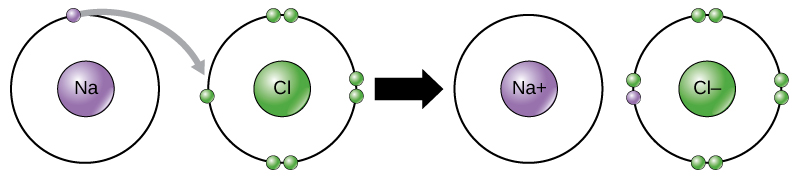
ويمكن تمثيل الرابطة برموز لويس بكتابة رموز العناصر، وتوضع عليها نقاط تمثل إلكترونات الغلاف الأخير.

انظر كيف تتكون رابطة أيونية بين الصوديوم والفلور:
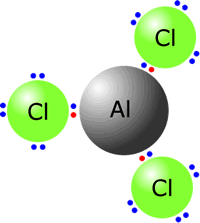
سؤال (1):
وضّح باستخدام رموز لويس كيف تنشأ الرابطة الأيونية بين:
الألمنيوم والكلور.
الإجابة:
سؤال (2):
كلوريد الكالسيوم مركب أيوني، يوجد في مياه البحر الميت، ويعدُّ مركباً أيونياً ذا أهميةٍ اقتصاديةٍ، وضح بالرسم كيف يرتبط الكلور مع الكالسيوم في هذا المركب.
الإجابة:
يميل الكالسيوم لفقد إلكترونين مكوناً أيوناً موجباً صيغته Ca2+ ، ويميل الكلور لكسب إلكترون مكوناً أيوناً سالباً صيغته -Cl ، ويرتبط أيون الكالسيوم مع أيوني كلور لتكوين كلوريد الكالسيوم.
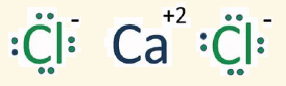
إعداد : شبكة منهاجي التعليمية
31 / 03 / 2022
النقاشات