سابعاً: خصائص المحاليل المائية
أولاً: التوصيل الكهربائي
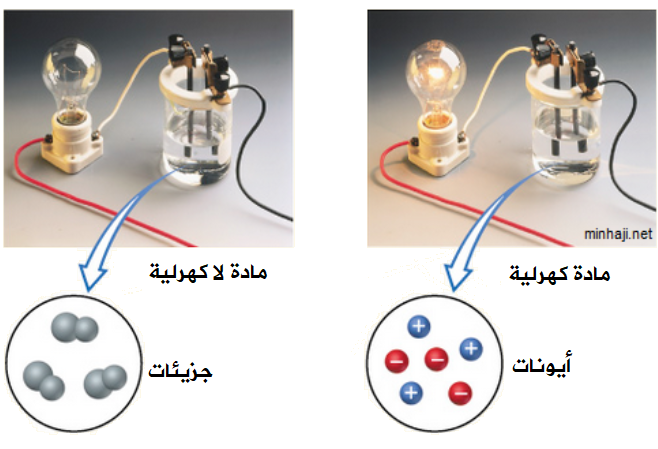
تقسم المواد الكيميائية وفق إيصالية محاليها للتيار الكهربائي إلى قسمين، هما:
- مركبات متأينة (كهرلية).
وهي المركبات التي تتفكك إلى أيونات موجبة وسالبة عند ذوبانها في الماء، فتوصل التيار الكهربائي، ومن أمثلتها ملح الطعام.
- مركبات غير متأينة (لاكهرلية).
وهي المركبات التي تتفكك إلى جزيئات غير مشحونة (متعادلة) عند ذوبانها في الماء، فلا توصل التيار الكهربائي، ومن أمثلتها السكر.
الأيون: ذرة أو مجموعة ذرات المرتبطة معاً، تحمل شحنة كهربائية موجبة أو سالبة.
كيف توصل المواد المتأينة التيار الكهربائي؟
لا توصل المواد المتأينة التيار الكهربائي وهي في حالة الصلابة، ولكنها توصل التيار في المحاليل المائية؛ لأنها تتفكك في الماء إلى أيونات، ويتحرك كل أيون نحو القطب المخالف له في الشحنة، مما يُكسب المحلول خصائصه الكهربائية.
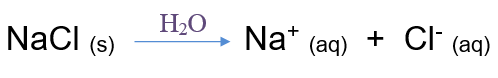
مثال:
يتفكك ملح الطعام (كلوريد الصوديوم) NaCl في الماء وفق المعادلة:
سؤال:
اكتب معادلات كيميائية تُمثّل تفكك كلّ من المركبات الأيونية الآتية في الماء:
CuSO4 , KBr , FeCl3 , NaOH , KNO3
الحل:

سؤال:
نظّم جدولاً للمقارنة بين المركبات الكهرلية والمركبات اللاكهرلية، كالآتي:
|
وجه المقارنة |
المركبات الكهرلية |
المركبات اللاكهرلية |
|
المكونات الأساسية |
|
|
|
التوصيل الكهربائي في حالة الصلابة |
|
|
|
التوصيل الكهربائي في حالة المحلول المائي (بشكلٍ عامٍ) |
|
|
الحل:
|
وجه المقارنة |
المركبات الكهرلية |
المركبات اللاكهرلية |
|
المكونات الأساسية |
أيونات |
جزيئات متعادلة |
|
التوصيل الكهربائي في حالة الصلابة |
غير موصل |
غير موصل |
|
التوصيل الكهربائي في حالة المحلول المائي (بشكلٍ عامٍ) |
موصل |
غير موصل |
ثانياً: الماء وسط للتفاعلات
تزداد سرعة تفاعل المواد الكيميائية في المحاليل المائية للمركبات المتأينة، فمثلاً تكون سرعة التفاعل بين محلولي كلوريد الحديد وهيدروكسيد الصوديوم أسرع من تفاعلهما وهما في حالة الصلابة، لأن الأيونات تكون حرة الحركة في حالة المحاليل المائية فيزيد من سرعة التقائها وبالتالي تزداد سرعة التفاعل.
أمثلة على تفاعلات تتم في الوسط المائي
تفاعلات الترسيب
تفاعلات الترسيب هي تفاعلات تؤدي إلى تكوين مادة غير ذائبة (راسب).
ومن الأمثلةِ عليها تفاعل محلولي كلوريد الصوديوم وكربونات الصوديوم، ويؤدي تفاعلهما إلى تكوين راسب عبارة عن كربونات الكالسيوم، كما في المعادلة:
CaCl2 + Na2CO3 → CaCO3(s) + 2NaCl
تفاعلات مُنتجة للغازات
ومن الأمثلةِ عليها تفاعل محلولي كلوريد الأمونيوم وهيدروكسيد الصوديوم، ويؤدي تفاعلهما إلى إنتاج غاز الأمونيا، كما في المعادلة:
NH4Cl + NaOH → NH3(g) + NaCl + H2O
إعداد : شبكة منهاجي التعليمية
22 / 12 / 2018
النقاشات