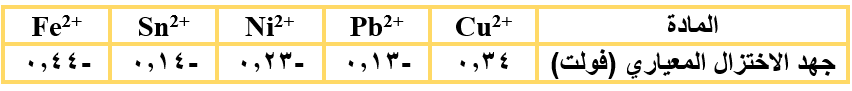
إذا أعطيت معادلة التأكسد والاختزال التالية:
2I-(aq) + Br2(l) → 2Br-(aq) + I2(s)
فإن إحدى العمليات التالية تحدث في التفاعل السابق:
المادة التي تمثل المهبط في الخلية الغلفانية التي يحدث فيها التفاعل التالي هي:
Ni2+ (aq) + Fe (s) → Ni (s) + Fe2+ (aq)
لديك الفلزات الافتراضية (X , Y , Z , M)، فإذا علمت أن:
الفلز X يختزل أيونات M ولا يختزل أيوني Y و Z .
يمكن تحريك محلول أحد أملاح الفلز Y بملعقة من الفلز M ولا يمكن تحريك المحلول بملعقة من الفلز Z .
الفلز الذي يسلك كأقوى عامل مختزل هو:
الشكل أدناه يمثل خلية غلفانية قطباها من القصدير والقطب (B).
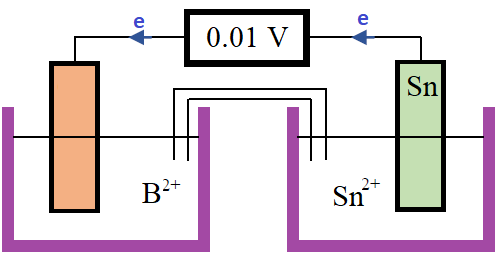
أي الأقطاب الفلزية من جدول جهود الاختزال أدناه يمكن استخدامه بدلاً من القطب (B) لتكتمل الخلية الغلفانية.