 |
معايرة حمض وقاعدة
يسمى تفاعل الحمض والقاعدة تفاعل التعادل.
وسمى هذا التفاعل بالتعادل؛ لأن أيونات H3O+ تتعادل مع أيونات OH- ويتكون الماء.
H3O+ (aq) + OH- (aq) → 2H2O (l)
أهمية تفاعل التعادل
يستخدم تفاعل التعادل في عملية المعايرة في تعيين تركيز مجهول (حمض أو قاعدة) من محلول تركيزه معلوم (حمض أو قاعدة)، ويسمى المحلول معلوم التركيز المحلول القياسي.
المعايرة: لإضافة التدريجية لمحلول قاعدة معلومة التركيز إلى محلول حمض مجهول التركيز، أو محلول حمض معلوم التركيز إلى محلول قاعدة مجهول التركيز.
خطوات المعايرة
- يحضر في دورق حجم محدد من محلول قياسي من حمض أو قاعدة.
- توضع قطرات من كاشف معين في المحلول القياسي، فيظهر المحلول بلون محدد.
- يضاف بالتدريج محلول مجهول التركيز من حمض أو قاعدة (يجب ان يكون المحلول عكس المحلول القياسي).
- نستمر بإضافة المحلول بالتدريج إلى أن يتغير لون المحلول في الدورق وعندها نصل إلى نقطة النهاية، وعندها تنتهي عملية المعايرة بوصول المحلول إلى نقطة التكافؤ أو نقطة التعادل.
نقطة النهاية: النقطة التي تضاف إلى المحلول ويتغير عندها لون الكاشف، وهي تحدد انتهاء عملية المعايرة.
نقطة التكافؤ: نقطة معينة يصبح عندها عدد مولات أيونات الهيدروكسيد OH- مكافئاً لعدد مولات أيونات الهيدرونيوم H3O+ في المحلول.
عند معايرة حمض قوي مع قاعدة قوية تسمى نقطة التكافؤ بنقطة التعادل.
نقطة التعادل: نقطة تتعادل عندها تماماً جميع أيونات الهيدرونيوم وأيونات الهيدروكسيد خلال عملية المعايرة، وتكون pH للمحلول تساوي 7 .
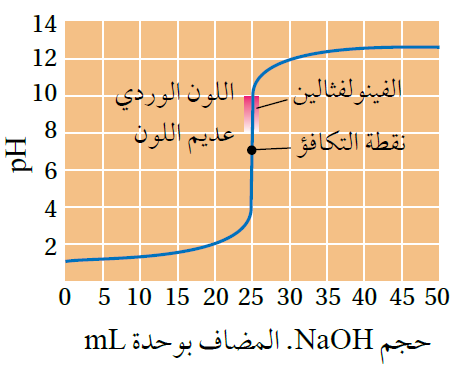
يستخدم في معايرة حمض قوي مع قاعدة قوية كاشف الفينولفثالين، ويتغير لونه من عديم اللون إلى اللون الوردي عند المرور بنقطة التعادل عند مدى من الرقم الهيدروجيني (8.2 - 10).
منحنى معايرة حمض قوي وقاعدة قوية
أثناء معايرة حمض قوي مع قاعدة قوية، لنفرض أن المحلول القياسي هو الحمض، والمحلول مجهول التركيز هو القاعدة.
- في البداية يكون لون المحلول الحمضي في الدورق عديم اللون.
- مع استمرار إضافة محلول القاعدة ترتفع قيمة pH تدريجياً مع بقاء المحلول عديم اللون.
- بعد إضافة كمية محددة من القاعدة نصل إلى نقطة التعادل حيث تتعادل أيونات OH- القادمة من القاعدة المضافة تماماً مع أيونات H3O+ الموجودة في المحلول القياسي، وتصبح قيمة pH للمحلول 7 .
- إضافة قطرة إضافية من محلول القاعدة يؤدي إلى تغير لون الكاشف إلى اللون الوردي، دلالة على مرور المحلول بمدى تغير لون الكاشف، وتحول المحلول إلى الوسط القاعدي.
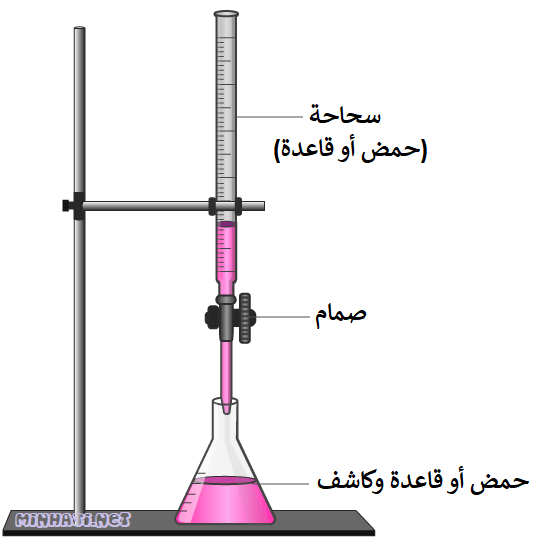
معلومة إضافية:
تستخدم في عملية المعايرة أداة تُسمى السحاحة.
حسابات نقطة التعادل
عند نقطة التعادل يكون:
عدد مولات الحمض = عدد مولات القاعدة
مثال (1):
أحسب تركيز الحمض HCl إذا تعادل 250 mL منه تماماً مع 200 mL من القاعدة NaOH تركيزها 0.02 M وفق المعادلة الآتية:
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l)
الحل:
عند نقطة التعادل يكون:
عدد مولات الحمض = عدد مولات القاعدة
n (NaOH) = n (HCl)
(M x V) NaOH = (M x V) HCl
(0.02 x 0.2) = (MHCl x 0.25)
MHCl = 0.016 M
مثال (2):
أحسب حجم الحمض HNO3 الذي تركيزه 0.4 M إذا تعادل تماماً مع 20 mL من محلول القاعدة LiOH تركيزه 0.2 M وفق المعادلة الآتية:
HNO3 (aq) + LiOH (aq) → LiNO3 (aq) + H2O (l)
الحل:
عند نقطة التعادل يكون:
عدد مولات الحمض = عدد مولات القاعدة
n (LiOH) = n (HNO3)
(M x V) LiOH = (M x V) HNO3
(0.2 x 0.02) = (0.4 x VHNO3)
VHNO3 = 0.01 L = 10 mL