 |
أسئلة وزارية (الحموض والقواعد)
الدورات (1997-2000)
دورة 1997
أ- المادة التي تسلك سلوكاً حمضياً وفق مفهوم لويس:
أ- Cl-
ب- OH-
ج- B(OH)3
د- NH3
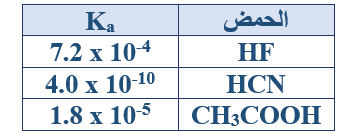 ب- يبين الجدول المجاور ثوابت التأين (Ka) لبعض الحموض:
ب- يبين الجدول المجاور ثوابت التأين (Ka) لبعض الحموض:
1- ما القاعدة المرافقة لكل من الحموض المذكورة؟
F- , CN- , CH3COO-
2- اكتب صيغة الحمض الأقوى.
HF
3- اكتب صيغة الحمض الذي تكون قاعدته المرافقة هي الأقوى.
HCN
ج- محلول منظم حجمه (1 L)، مكون من القاعدة NH3 تركيزها 0.4 M والملح NH4Cl مجهول التركيز، فإذا علمت أن (pH) للمحلول = 9 ،
وأن Kb لـ NH3 = (2 x 10-5)، وأن Kw = 1 x 10-14 فأجب عما يأتي:
1- اكتب صيغة الأيون المشترك في المحلول.
NH4+
2- احسب تركيز الملح NH4Cl في المحلول.
[H3O+] = 10-pH = 10-9 = 1 x 10-9 M
[OH-] = = = 1 x 10-5 M
Kb =
2 x 10-5 =
[NH4+] = [NH4Cl] = 0.8 M
3- ماذا يصبح [OH-] في المحلول المنظم إذا أضيف إليه 0.2 mol من HCl ؟
(اهمل التغير في الحجم)
[HCl] = = = 0.2 M
Kb =
2 x 10-5 = =
[OH-] = 0.4 x 10-5 = 4 x 10-6 M
دورة 1998
أ- انقل الإجابة الصحيحة لكل فقرة إلى دفتر إجابتك:
1- إذا كانت قيمة pH تساوي (3) لمحلول من الحمض الضعيف HA تركيزه (0.1 M). فإن قيمة Ka لهذا الحمض تساوي:
أ- 1 x 10-5
ب- 1 x 10-6
ج- 1 x 10-7
د- 1 x 10-8
2- أي من محاليل الأملاح الآتية له أقل رقم هيدروجيني (pH):
أ- NaNO3
ب- KCN
ج- Na2CO3
د- NH4Cl
ب- وضّح المقصود بالقاعدة حسب مفهوم لويس.
القاعدة: مادة يمكنها منح زوج أو أكثر من الإلكترونات في أثناء التفاعل.
ج- في التفاعل الآتي:
HF(aq) + HCO3-(aq) H2CO3(aq) + F-(aq)
1- حدد الزوجين المرافقين من الحمض والقاعدة.
(HF/F-) , (HCO3-/H2CO3)
2- بين أي الاتجاهين يرجح الاتزان علماً بأن لـ HF = 7.2 x 10-4 ولـ H2CO3 = 4.3 x 10-7 .
يرجح الاتزان جهة النواتج (الاتجاه الأمامي).
د- بيّن ما يحدث لقيمة pH ( تقل ، تزداد ، تبقى ثابتة) في الحالات التالية، ثم فسّر إجابتك.
1- عند إضافة ملح NaNO2 إلى محلول HNO2 .
تزداد.
2- عند إضافة ملح NH4Cl إلى محلول NH3.
تقل.
دورة 1999
أ- انقل الإجابة الصحيحة إلى دفتر إجابتك.
أي من الآتية يسلك كحمض في تفاعلات وكقاعدة في تفاعلات أخرى حسب مفهوم برونستد ولوري؟
أ- CO32-
ب- H2S
ج- H2SO3
د- HCO3-
ب- محلول منظم حجمه (1 L)، مكون من N2H4 بتركيز (0.1 M) وملح N2H5Br بتركيز (0.2 M)، فإذا علمت أن Kb (N2H4) = 1 x 10-6 ،= 1 x 10-14 Kw :
1- اكتب معادلة تأين N2H4 في الماء.
N2H4 + H2O N2H5+ + OH-
2- اكتب صيغة الأيون المشترك في المحلول.
N2H5+
3- احسب قيمة pH بعد إضافة (2 g) من NaOH الصلب إلى المحلول المنظم (اهمل التغير في الحجم) علماً بأن الكتلة المولية لـ NaOH = 40 g/mol
أحسب عدد مولات القاعدة NaOH :
n = = = 0.05 mol
أحسب تركيز القاعدة NaOH :
M = = = 0.05 M
Kb =
1 x 10-6 = =
[OH-] = 1 x 10-6 M
[H3O+] = = = 1 x 10-8 M
pH = -log [H3O+] = -log (1 x 10-8) = 8
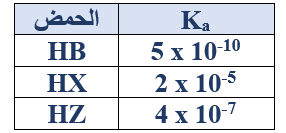 ج- ادرس الجدول المجاور والذي يبين قيم Ka لبعض الحموض ثم أجب عما يأتي:
ج- ادرس الجدول المجاور والذي يبين قيم Ka لبعض الحموض ثم أجب عما يأتي:
1- اكتب صيغة الحمض الأضعف.
HB
2- رتب محاليل الأملاح NaZ , NaX , NaBالمتساوية في التركيز تصاعدياً حسب زيادة الرقم الهيدروجيني.
NaB > NaZ > NaX
3- احسب [H3O+] لمحلول من HZ تركيزه (1 x 10-3 M).
Ka = =
4 x 10-7 =
[H3O+] = = 2 x 10-5 M
د- تزداد قيمة pH عند إذابة الملح NaF في الماء … فسر ذلك.
الملح NaF قاعدي، عند إذابته في الماء يتفكك وفق المعادلة:
NaF Na+ + F-
يتفاعل أيون F- مع الماء وفق المعادلة الآتية:
F- + H2O HF + OH-
فيزداد تركيز أيون الهيدروكسيد وتزداد قيمة pH .
هـ- قارن بين المركبين (NCl3) و (BCl3) من حيث السلوك كحمض أو قاعدة (حسب مفهوم لويس).
المركب: NCl3 قاعدة، والمركب: BCl3 حمض.
دورة 2000
أ- انقل إلى دفتر إجابتك الإجابة الصحيحة للفقرة الآتية:
المادة التي تعد من حموض لويس من المواد الآتية هي:
أ) H2O
ب) Zn2+
ج) OH-
د) NH3
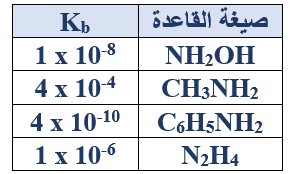 ب- اعتماداً على الجدول المجاور والذي يمثل قيمة ثابت التأين (Kb) لعدد من القواعد الضعيفة، أجب عما يأتي:
ب- اعتماداً على الجدول المجاور والذي يمثل قيمة ثابت التأين (Kb) لعدد من القواعد الضعيفة، أجب عما يأتي:
1- اكتب صيغة الحمض المرافق الأقوى.
C6H5NH3+
2- اكتب معادلة تفاعل NH2OH مع الماء.
NH2OH + H2O NH2OH2+ + OH-
3- حدد الزوجين المرافقين من الحمض والقاعدة في التفاعل السابق.
(NH2OH/NH2OH2+) , (H2O/OH-)
4- أيهما أكبر: قيمة pH لمحلول CH3NH2 أم لمحلول C6H5NH2 (التركيز نفسه)؟
CH3NH2
5- احسب قيمة pH لمحلول N2H4 تركيزه (0.01 M) مستعيناً بمعادلة التفاعل الآتية:
N2H5+ + OH- N2H4 + H2O (Kw = 1 x 10-14)
Kb = =
1 x 10-6 =
[OH-] = = 1 x 10-4 M
pOH = - log [OH-] = - log (1 x 10-4) = 4
pH = 14 - 4 = 10
ج- فسّر السلوك الحمضي لأيون (NH4+) وفق مفهوم برونستد - لوري للحمض.
الأيون NH4+ حمض؛ لأنه مانح بروتون أثناء التفاعل.
NH4+ + H2O NH3 + H3O+
د- محلول منظّم مكون من حمض CH3COOH (Ka = 2 x 10-5) وتركيزه (0.4 M) وملح CH3COONa تركيزه (0.5 M) ، أجب عما يأتي: (الكتلة المولية لـ NaOH = 40 g/mol)
1- اكتب صيغة الأيون المشترك.
CH3COO-
2- احسب تركيز (H3O+) في المحلول.
Ka =
2 x 10-5 =
[H3O+] = 1.6 x 10-5 M
3- كم غراماً من (NaOH) الصلب يجب إذابتها في لتر من المحلول المنظم لتصبح قيمة pH للمحلول النهائي = 5 ؟
[H3O+] = 10-pH = 10-5 = 1 x 10-5 M
Ka =
2 x 10-5 =
2 =
0.8 - 2x = 0.5 + x
0.8 - 0.5 = x + 2x
3x = 0.3
x = 0.1 M = [NaOH]
n = M x V = 0.1 x 1 = 0.1 mol
m = n x Mr = 0.1 x 40 = 4 g