 |
إجابات أسئلة مراجعة الوحدة
السؤال الأول:
أوضح المقصود بكل مما يأتي:
التفاعلات غير المنعكسة: تفاعلات تسري باتجاه واحد نحو تكوين المواد الناتجة.
اتزان ديناميكي: حالة يصل إليها التفاعل ويستمر عندها حدوث التفاعل بالاتجاهين الأمامي والعكسي بالسرعة نفسها.
ثابت الاتزان: تعبير يمثل نسبة تراكيز المواد الناتجة إلى تراكيز المواد المتفاعلة مرفوعاً كلّ منها إلى قوة تساوي معاملاتها في المعادلة الموزونة.
الاتزان غير المتجانس: حالة الاتزان التي تكون فيها المواد المتفاعلة والناتجة في حالة فيزيائية متنوعة (صلبة، أو سائلة، أو غازية).
ثابت تأين القاعدة الضعيفة: ثابت الاتزان لتأين القاعدة الضعيفة في الماء.
السؤال الثاني:
أوضح: يتفاعل ثاني أكسيد الكبريت SO2 مع الكلور Cl2 وفق المعادلة الآتية:
SO2 (g) + Cl2 (g) SO2Cl2 (g) + Heat
أوضح أثر التغيرات الآتية على موضع الاتزان:
أ- زيادة تركيز Cl2 .
يزاح موضع الاتزان نحو اليمين (المواد الناتجة).
ب- سحب SO2Cl2 من الوعاء.
يزاح موضع الاتزان نحو اليمين (المواد الناتجة).
ج- تقليل كمية SO2 في وعاء التفاعل.
يزاح موضع الاتزان نحو اليسار (المواد المتفاعلة).
السؤال الثالث:
أتوقع أثر خفض درجة الحرارة على موضع الاتزان للتفاعلين المتزنين الآتيين:
أ- C2H4 (g) + H2O (g) C2H5OH (g) ΔH = -46 kJ
يزاح موضع الاتزان نحو اليمين (المواد الناتجة).
ب- N2 (g) + O2 (g) 2NO (g) ΔH = +90 kJ
يزاح موضع الاتزان نحو اليسار (المواد المتفاعلة).
السؤال الرابع:
أتوقع التفاعل الذي ينتج أكبر كمية من المواد عند زيادة الضغط الكلي المؤثر في وعاء التفاعل بين التفاعلات الآتية:
أ- PCl5 (g) PCl3 (g) + Cl2 (g)
ب- N2 (g) + 3H2 (g) 2NH3 (g)
ج- N2O4 (g) 2NO2 (g)
د- + 3H2 (g) CH4 (g) + H2O (g) CO (g)
السؤال الخامس:
أتنبأ بموضع الاتزان عند تقليل حجم الوعاء في العمليات الآتية مبرراً تنبؤاتي:
أ- تحلل المركب SO2Cl2 كما في المعادلة:
SO2Cl2 (g) SO2 (g) + Cl2 (g)
جهة المواد المتفاعلة؛ لأن تقليل حجم الوعاء يزيد من الضغط، وحسب مبدأ لوتشاتلييه يزاح موضع الاتزان نحو عدد المولات الأقل.
ب- تحضير الميثانول كما في التفاعل المتزن الآتي:
CO (g) + 2H2 (g) CH3OH (g)
جهة المواد الناتجة؛ لأن تحتوي عدد مولات أقل.
ج- تفاعل ثلاثي كلوريد الفسفور PCl3 مع الأمونيا كما في المعادلة الآتية:
PCl3 (g) + 3NH3 (g) P(NH2)3 (g) + 3HCl (g)
لا يتأثر؛ لأن عدد المولات نفسه على جانبي التفاعل.
السؤال السادس:
أطبق أكتب تعبير ثابت الاتزان لكل من التفاعلات الآتية:
أ- CaCO3 (s) CaO (s) + CO2 (g)
Kc = [CO2]
ب- 2N2O5 (g) 2N2O4 (g) + O2 (g)
Kc =
ج- [Cu(H2O)4]2+ (aq) + 4NH3 (aq) [Cu(NH3)4]2+ (aq) + 4H2O (l)
Kc =
د- HNO2 (aq) + H2O (l) NO2- (aq) + H3O+ (aq)
Kc =
هـ- C5H5N (aq) + H2O (l) C5H5NH+ (aq) + OH- (aq)
Kc =
السؤال السابع:
أفسر:
أ- لا يتأثر موضع الاتزان عند تغيير الضغط الكلي في وعاء التفاعل عند الاتزان للتفاعل الآتي:
CO (g) + H2O (g) CO2 (g) + H2 (g)
لأن عدد مولات المواد المتفاعلة مساوياً لعدد مولات المواد الناتجة حسب المعادلة الموزونة.
ب- يمكن زيادة كمية الناتج SCN- بترسيب أيونات الحديد Fe3+ من المحلول في التفاعل المتزن الآتي:
FeSCN2+ (aq) Fe3+ (aq) + SCN- (aq)
لأن ترسيب أيونات Fe2+ يقلل من تركيزها في المواد الناتجة، ما يسبب إزاحة موضع الاتزان نحو المواد الناتجة تبعاً لمبدأ لوتشاتلييه، فيزداد تركيز أيونات SCN- .
السؤال الثامن:
أحلل البيانات وأفسرها: يبين الجدول الآتي نتائج دراسة ثابت الاتزان لتفاعل ما عند درجات حرارة مختلفة، هل التفاعل ماص للحرارة أم طارد لها؟
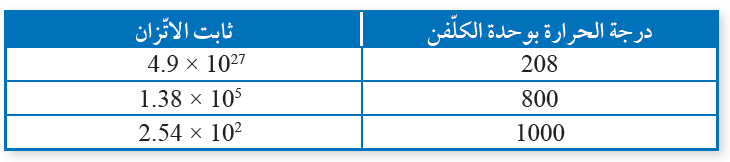
يتضح من البيانات أن زيادة درجة الحرارة تزيد من ثابت الاتزان، وحسب مبدأ لوتشاتلييه فإن موضع الاتزان يزاح إلى الجهة التي تمتص تلك الحرارة، وبما أن ثابت الاتزان يزداد فذلك يشير أن تراكيز المواد الناتجة تزداد، ما يشير إلى أن التفاعل ماص للحرارة.
السؤال التاسع:
تحضر الأمونيا NH3 بتسخين مزيج من غاز النيتروجين N2 وغاز الهيدروجين H2 عند ضغط معين، كما في المعادلة الآتية:
3N2 (g) + 3H2 (g) 2NH3 (g)
ضغطت كمية من غازي النيتروجين والهيدروجين إلى وعاء حجمه 10 L ، وسخنت إلى درجة حرارة 350 oC ؛ ليصل التفاعل إلى حالة الاتزان، حيث وجد أن عدد مولات النيتروجين والهيدروجين والأمونيا عند الاتزان تساوي: 1.5 , 5.75 , 4.25 على الترتيب.
أ- أحسب ثابت الاتزان للتفاعل عند 350 oC
ب- أقارن هذه النتائج بقيم ثابت الاتزان في الجدول رقم (1)، وأبرر هذا الاختلاف.
يتضح أن ثابت الاتزان الناتج أكبر عند درجة 350 oC من ثابت الاتزان في الجدول، حيث درجة الحرارة 500 oC ، وحيث أن التفاعل طارد للحرارة فإن انخفاض درجة الحرارة يدفع موضع الاتزان نحو المواد الناتجة، ما يزيد من تراكيز المواد الناتجة ويزيد من ثابت الاتزان.
السؤال العاشر:
وجد أن ثابت الاتزان للتفاعل الآتي يساوي Kc = 4 x 1013 عند درجة 25 oC
2NO (g) + O2 (g) 2NO2 (g)
أ- أتوقع المواد المتوافرة بكمية أكبر في وعاء التفاعل عند الاتزان.
حيث أن ثابت كبير فإن المواد المتوافرة بكمية أكبر هي المواد الناتجة.
ب- أحسب تركيز NO2 عند يكون [NO] = [O2] = 2 x 10-6 M
Kc =
[NO2]2 = Kc [NO]2 [O2]
[NO2]2 = 4 x 1013 (2 x 10-6)2 x 2 x 10-6 = 3.2 x 10-4
[NO2] = 1.78 x 10-2 M
السؤال الحادي عشر:
أطبق: يحدث التفاعل الآتي في وعاء مغلق حجمه 1 L
NO2 (g) + SO2 (g) NO (g) + SO3 (g)
السؤال الثاني عشر:
أطبق: يتحلل غاز بروميد اليود IBr وفق المعادلة الآتية:
2IBr (g) I2 (g) + Br2 (g)
إحدى التجارب جرى فيها تحليل 0.1 mol من بروميد اليود في وعاء حجمه 1 L عند درجة 100 oC ، وكان ثابت الاتزان يساوي 0.026 ، أحسب تراكيز المواد عند وصول التفاعل إلى حالة الاتزان.
السؤال الثالث عشر:
أحلل النتائج وأفسرها: تصنع الأمونيا بتسخين مزيج من غازي النيتروجين والهيدروجين بوجود عامل مساعد من معدن المغنتيت الصلب، كما في المعادلة الآتية:
3N2 (g) + 3H2 (g) 2NH3 (g) ΔH = -92 kJ
ويبين الشكل المجاور نسبة الأمونيا الناتجة عند ظروف مختلفة من الضغط ودرجة الحرارة، أدرس المنحنى وأجيب عن الأسئلة الآتية:
أ- أفسر: أستخدم مبدأ لوتشاتيلييه لتفسير أثر زيادة درجة الحرارة على نسبة الأمونيا الناتجة.
حيث أن التفاعل طارد للحرارة فإن خفض درجة الحرارة يؤدي إلى إزاحة موضع الاتزان نحو المواد الناتجة (تكوين الأمونيا) وفق مبدأ لوتشاتلييه، ما يزيد من معدل تكوين الأمونيا.
ب- أفسر: أستخدم مبدأ لوتشاتيلييه لتفسير أثر زيادة الضغط على نسبة الأمونيا الناتجة.
وفق مبدأ لوتشاتلييه فإن زيادة الضغط تؤدي إلى إزاحة موضع الاتزان نحو الجهة الأقل عدد مولات، أي نحو تكوين الأمونيا، وبهذا يزداد معدل تكوينها.
ج- أكتب تعبير ثابت الاتزان للتفاعل باستخدام تراكيز المواد، وكذلك باستخدام الضغوط الجزئية للغازات.
Kc =
Kp =
السؤال الرابع عشر:
أحلل النتائج: يبين الشكل المجاور النتائج التجريبية لخليط من الغازات (SO3 , SO2 , O2) عند الاتزان، أدرس الشكل وأجيب عن الأسئلة الآتية:
أ- أحدد المنحنى الذي يمثل المواد المتفاعلة والمنحنى الذي يمثل المواد الناتجة.
يمثل المنحنيين باللون الأزرق المواد الناتجة، ويمثل المنحنى باللون الأحمر المواد المتفاعلة.
ب- أكتب معادلة التفاعل الموزونة.
2SO3 (g) 2SO2 (g) + O2 (g)
ج- أحسب ثابت الاتزان للتفاعل في ضوء هذه النتائج.
Kc = = = 3.2
السؤال الخامس عشر:
تغطي الأسنان طبقة من المعادن تسمى طبقة المينا؛ تعمل على حماية الأسنان من التآكل.
أ- أسمي المعدن الأساسي التي تتكون منه هذه الطبقة.
معدن هيدروكسي أباتيت.
ب- أوضح عملية إزالة المعدن وأكتب معادلة كيميائية تبين ذلك.
تتآكل الأسنان وتصاب بالتسوس نتيجة ذوبان معدن هيدروكسي أباتيت المكون للمينا، ويزيد تآكلها تخمر بواقي السكريات في الفم التي تؤدي إلى إنتاج أيونات H+ ما يزيد من تفكك معدن الهيدروكسي أباتيت.
Ca5(PO4)3OH 5Ca2+ + 3PO43- + OH-
ج- أسمي المادة المستخدمة في إعادة بناء المعدن.
تستخدم مركبات الفلور مثل فلوريد الصوديوم في إعادة تكوين المعدن.
د- أوضح كيفية بناء المعدن في الأسنان.
تدخل مركبات الفلور في صناعة معجون الأسنان؛ إذ يحل الفلور محل مجموعة OH في الهيدروكسي أباتيت ويتكون معدن الفلورو أباتيت Ca5(PO4)3F الذي يدخل في تكوين مينا الأسنان ويعيد تكوينها.
السؤال السادس عشر:
اختار الإجابة الصحيحة لكل فقرة في ما يأتي:
1) أحدد التفاعل الذي يُنتج كمية أكبر من النواتج عند زيادة الضغط المؤثر على وعاء التفاعل:
أ- I2 (g) + Br2 (g) 2IBr (g)
ب- 2NH3 (g) N2 (g) + 3H2 (g)
ج- 2NO (g) + Br2 (g) 2NOBr (g)
د-+ 3H2 (g) CH4 (g) + H2O (g) CO (g)
2) يؤدي سحب غاز NH3 من وعاء التفاعل الآتي إلى:
4NH3 (g) + 5O2 (g) 4NO (g) + 6H2O (g)
أ- زيادة سرعة التفاعل الأمامي.
ب- زيادة إنتاج غاز NO
ج- إزاحة موضع الاتزان نحو اليمين.
د- إزاحة موضع الاتزان نحو اليسار.
3) يعد تحليل الماء إحدى طرق تحضير الهيدروجين كما في التفاعل الآتي:
2H2O (g) 2H2 (g) + O2 (g) ΔH = +48 kJ
أحدد أي الإجراءات الآتية يؤدي إلى زيادة كمية الهيدروجين الناتجة هو:
أ- زيادة درجة الحرارة.
ب- خفض درجة الحرارة.
ج- زيادة الضغط المؤثر.
د- إضافة كمية من غاز الأكسجين.
4) العبارة الصحيحة في ما يتعلق بالتفاعل عند الاتزان في ما يأتي:
أ- تراكيز المواد الناتجة مساوٍ لتراكيز المواد المتفاعلة.
ب- موضع الاتزان مزاح نحو تكوين المواد المتفاعلة.
ج- سرعة التفاعل الأمامي مساوية لسرعة التفاعل العكسي.
د- تعتمد قيمة ثابت الاتزان على التراكيز الابتدائية للمواد في التفاعل.
5) الشكل الذي يعبر عن تغير تركيز NO2 في أثناء سير التفاعل والوصول إلى حالة الاتزان للتفاعل الآتي هو:
NO2 (g) N2O4 (g)
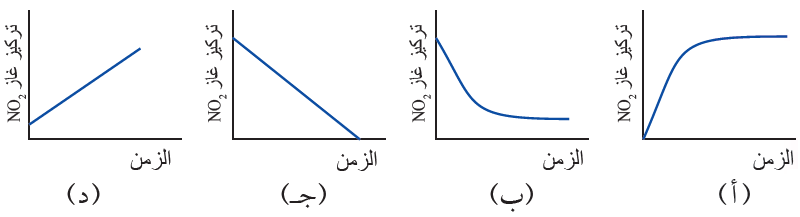
الإجابة: ب