 |
مراجعة الوحدة الأولى
الحموض والقواعد وتطبيقاتها
1- أوضح المقصود بكل ممّا يأتي:
- قاعدة لويس.
- حمض لويس.
- المحلول المنظم.
2- أفسر:
أ- السلوك الحمضي لمحلول HNO2 حسب مفهوم برونستد - لوري.
ج- السلوك الأمفوتيري لتفاعل HS- عند تفاعله مع كل من HCl و NO2- .
3- أحدد الأزواج المترافقة في التفاعلات الآتية:
HNO2 (aq) + CN- (aq) NO2- (aq) + HCN (aq)
C5H5N (aq) + HCl (aq) C5H5NH+ (aq) + Cl- (aq)
4- أحدد حمض لويس وقاعدته في التفاعل الآتي:
Co2+ (aq) + 6NH3 (aq) Co(NH3)62+ (aq)
5- أحسب الرقم الهيدروجيني لمحلول هيدروكسيد الصوديوم NaOH مكون بإذابة 4 g منه في 200 mL من الماء.
علماً أن الكتلة المولية للقاعدة 40 g/mol = NaOH . (log 2 = 0.3)
6- أحسب. جرت معايرة 10 mL من محلول LiOH ، فتعادلت مع 20 mL من محلول HBr تركيزه 0.01 M أحسب تركيز المحلول LiOH .
7- أضيف 40 mL من محلول KOH تركيزه 0.4 M إلى 20 mL من محلول HBr تركيزه 0.5 M . أحسب قيمة pH للمحلول الناتج.
8- تمثل المعادلات الآتية تفاعلات لمحاليل الحموض (H2SO3 , HCN , HF) المتساوية التركيز، التي كان موضع الاتزان مزاحاً فيها جهة المواد الناتجة لجميع التفاعلات. أدرس التفاعلات، ثم أجيب عن الأسئلة التي تليها:
H2SO3 + CN- HSO3- + HCN
H2SO3 + F- HSO3- + HF
HF + CN- F- + HCN
أ- أكتب صيغة القاعدة المرافقة الأقوى بينها.
ب- أكتب صيغة الحمض الذي له أعلى Ka .
ج- أحدد أي المحلولين يكون فيه [OH-] الأقل: محلول HF أم محلول HCN .
د- أحدد أي محاليل الحموض المذكورة له أعلى pH .
9- محلول حجمه 2 L يتكون من 0.2 M من حمض RCOOH ، ورقمه الهيدروجيني pH = 4 ، أضيف إليه كمية من الملح RCOONa فتغيرت قيمة pH بمقدار 1.52 درجة. أحسب عدد مولات الملح المضاف. علماً أن , log 3 = 0.48 (أهمل التغير في الحجم)
10- محلول منظم يتكون من الحمض HNO2 ، الذي تركيزه 0.3 M ، والملح KNO2 ، الذي تركيزه 0.2 M
علماً أن Ka = 4.5 x 10-4 ،log 6.75 = 0.83 ، log 4.5 = 0.65
أ- أحسب pH للمحلول.
ب- أحسب pH للمحلول السابق، إذا أضيف إليه 0.1 mol من القاعدة NaOH إلى 1 L منه.
11- محلول منظم يتكون من القاعدة CH3NH2 ، التي تركيزها 0.3 M ، والملح CH3NH3Cl الذي تركيزه 0.2 M ، أحسب:
علماً أنّ Kb = 4.4 x 10-4
كتلة الحمض HCl اللازم إضافتها إلى لتر من المحلول لتصبح pH = 10 .
علماً أنّ Mr (HCl) = 36.5 mol/g
12- يبين الجدول الآتي الرقم الهيدروجيني لعدد من المحاليل المختلفة المتساوية التركيز. أدرسها، ثم أختار منها المحلول الذي تنطبق عليه فقرة من الفقرات الآتية:
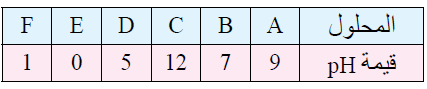
أ- قاعدة يكون فيها [OH-] = 1 x 10-5 M
ب- المحلول الذي يمثل الملح KBr
ج- محلول حمض HNO3 تركيزه 1 M
د- محلول قاعدي تركيز [H3O+] فيه أقل ما يمكن.
هـ- محلول أيوناته لا تتفاعل مع الماء.
13- يحتوي الجدول الآتي على معلومات تتعلق ببعض الحموض والقواعد الضعيفة. أدرس المعلومات، ثم أجيب عن الأسئلة التي تليها:
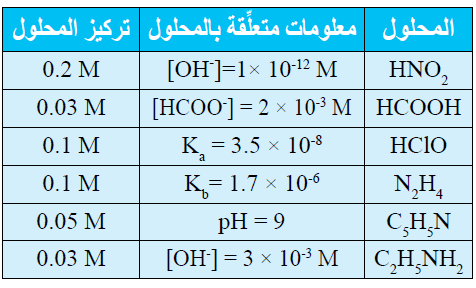
أ- أحسب تركيز [H3O+] في محلول HClO .
ب- أحدد أي المحلولين يحتوي على تركيز أعلى من [OH-] : محلول HClO أم محلول HNO2 .
ج- أحدد أي الملحين أكثر قدرة على التميه: KNO2 أم HCOOK
د- أقرر أيها أقوى: الحمض المرافق للقاعدة C5H5N أم الحمض المرافق للقاعدة C2H5NH2 .
هـ- أحدد أي المحلولين يحتوي على تركيز أعلى من [H3O+] : محلول C5H5N أم محلول C2H5NH2 .
و- أحدد أي المحلولين له أعلى رقم هيدروجيني (pH): محلول N2H5Cl أم C2H5NH2 .
ز- أحسب الرقم الهيدروجيني لمحلول HCOOH عند إضافة 0.01 mol من الملح HCOONa إلى لتر من المحلول.
14- أحسب pH لمحلول يتكون من الحمض HNO2 ومحلول الملح KNO2 ، لهما التركيز نفسه.
Ka = 4.5 x 10-4 ، log 4.5 = 0.65
15- أتوقع ما يحدث لقيمة pH في الحالت الآتية (تقل، تزداد، تبقى ثابتة): (أهمل التغير في الحجم)
- إضافة كمية قليلة من بلورات الملح NaHCO3 إلى 500 mL من محلول الحمض H2CO3 .
- إضافة كمية قليلة من بلورات الملح N2H5NO3 إلى 500 mL من محلول القاعدة N2H4 .
- إضافة كمية قليلة من بلورات الملح LiCl إلى 500 mL من محلول الحمض HCl .
16- يحتوي الجدول الآتي على عدد من المحاليل تركيز كل منها 1 M وبعض المعلومات المتعلقة بها. أدرس المعلومات، ثم أجيب عن الأسئلة الآتية:
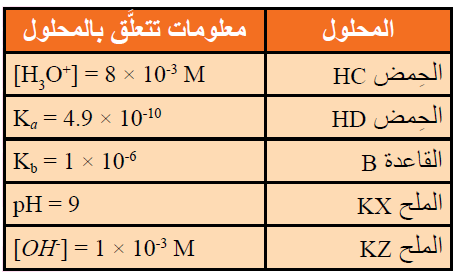
أ- أيهما أضعف الحمض HX أم الحمض HZ ؟
ب- أكتب معادلة لتفاعل محلول الحمض HD والأيون C- ، ثم:
- أحدد الزوجين المترافقين في المحلول.
- أتوقع الجهة التي يرجحها الاتزان في التفاعل.
ج- أستنتج القاعدة المرافقة الأضعف: D- أم C- .
د- أحسب تركيز H3O+ في محلول مكون من القاعدة B ، التي تركيزها 1 M ، والملح BHCl الذي تركيزه 0.5 M
17- أختار الإجابة الصحيحة لكل فقرة في ما يأتي:
1- يكون تركيز الأيونات الناتجة عن تأين أحد المحاليل الآتية في الماء عند الظروف نفسها أعلى ما يمكن:
أ) NH3
ب) NaOH
ج) HCOOH
د) HClO
2- العبارة الصحيحة، في المعادلة (HA + H2O H3O+ + A-)، هي:
أ) يتأين الحمض HA كلياً.
ب) الحمض HA يختفي من المحلول.
ج) الحمض HA ضعيف.
د) لا يوجد أزواج مترافقة في المعادلة.
3- القاعدة المرافقة الأضعف في ما يأتي، هي:
أ) NO3-
ب) OCl-
ج) F-
د) CN-
4- المحلول الذي لم يتمكن مفهوم أرهينيوس من تفسير سلوكه، هو:
أ) HCl
ب) NaCN
ج) HCOOH
د) NaOH
5- أحد الأيونات الآتية لا يعد أمفوتيرياً:
أ) H2PO4-
ب) HS-
ج) HCO3-
د) HCOO-
6- المادة التي تتأين في الماء وتنتج أيون الهيدروكسيد (OH-)، هي:
أ) حمض أرهينيوس.
ب) قاعدة لويس.
ج) قاعدة أرهينيوس.
د) قاعدة برونستد - لوري.
7- المادة التي تستطيع استقبال زوج من الإلكترونات غير رابط من مادة أخرى، هي:
أ) F-
ب) Cu2+
ج) BF4-
د) CO32-
8- إذا كان [H3O+] = 2 x 10-2 M في محلول ما، فإن [OH-] هو:
أ) 1 x 10-2 M
ب) 2 x 10-12 M
ج) 1 x 10-10 M
د) 5 x 10-13 M
9- محلول حمض HBr :
أ) عدد مولات H3O+ تساوي فيه عدد مولات OH-
ب) عدد مولات H3O+ أقل فيه عدد مولات OH-
ج) عدد مولات H3O+ تساوي فيه عدد مولات HBr المذابة
د) عدد مولات Br- تساوي فيه عدد مولات OH-
10- المحلول الذي له أعلى pH في المحاليل الآتية التي لها التركيز نفسه، هو:
أ) NH4Cl
ب) HBr
ج) NaCl
د) NH3
11- المحلول الذي له أقل قيمة pH في المحاليل الآتية المتساوية في التركيز، هو:
أ) KNO3
ب) NaOH
ج) HNO2
د) HNO3
12- المحلول الذي له أقل تركيز H3O+ في المحاليل الآتية المتساوية التركيز، هو:
أ) HCl
ب) N2H5Br
ج) KNO2
د) NH4Cl
13- ترتيب المحاليل المائية للمركبات الآتية (LiOH , N2H5Cl , KNO2 , NaCl) المتساوية في التركيز حسب رقمها الهيدروجيني pH ، هو:
أ) KNO2 > N2H5Cl > NaCl > LiOH
ب) LiOH > KNO2 > N2H5Cl > NaCl
ج) N2H5Cl > NaCl > KNO2 > LiOH
د) LiOH > KNO2 > NaCl > N2H5Cl
14- ينتج الأيون المشترك N2H5+ من المحلول المكون من:
أ) N2H4/HNO3
ب) N2H5Br/HBr
ج) N2H4/H2O
د) N2H5NO3/ N2H4