 |
إجابات أسئلة مراجعة الوحدة
التفاعلات والحسابات الكيميائية
السؤال الأول:
أوضح المقصود بالمفاهيم الآتية:
تفاعل الإحلال المزدوج، تفاعل التعادل، المعادلة الأيونية.
تفاعل الإحلال المزدوج: إحلال الأيون الموجب (أو السالب) من مركبٍ محلّ الأيون الموجب (أو السالب) من مركب آخر.
تفاعل التعـادل: تفاعل حمض مع قاعدة لإنتاج الملح والماء.
المعادلة الأيونية الكاملة: المعادلة التي تظهر فيها الجسيمات التي في المحلول جميعها.
السؤال الثاني:
يتفاعل 200 g من Na مع 200 g من الأكسجين وفق المعادلة الموزونة الآتية:
4Na (s) + O2 (g) → 2Na2O (s)
أ- أحدد النسبة المولية للصوديوم Na .
,
ب- أستنتج المادة المحددة للتفاعل.
n Na = x 200 g Na = 8.69 mol
n O2 = x 200 g O2 = 6.25 mol
عدد مولات الصوديوم = 25 mol
عدد المولات المطلوبة 25 mol والمتوافرة 8.69 mol ، لذلك المادة المحددة للتفاعل هي Na والفائضة O2 .
ج- أحسب كتلة Na2O الناتجة.
عدد مولات Na2O الناتجة:
x 8.69 mol Na = 4.35 mol Na2O
كتلة Na2O الناتجة:
x 4.35 mol Na2O = 269.7 g Na2O
د- أحسب كتلة المادة الفائضة.
الكتلة التي تفاعلت:
x 6.25 mol O2 = 200 g
كتلة المادة الفائضة (الفرق بين الكتلة المتوافرة والكتلة المتفاعلة):
269.7 – 200 = 69.7 g
السؤال الثالث:
يتفاعل محلول كلوريد النحاس CuCl2 II ، مع محلول فوسفات البوتاسيوم K3PO4 ، فينتج محلول كلوريد البوتاسيوم KCl ، وراسب صلب من فوسفات النحاس Cu3(PO4)2 . أجيب عن الأسئلة الآتية:
أ- أكتب المعادلة الكيميائية الموزونة.
2K3PO4(aq) + 3CuCl2(aq) → 6KCl(aq) + Cu3(PO4)3(s)
ب- أكتب المعادلة الأيونية.
6K+(aq) + 2PO43-(aq) + 3Cu2+(aq) + 6Cl-(aq) → Cu3(PO4)3(s) + 6K+(aq) + 6Cl-(aq)
ج- أستنتج المعادلة الأيونية النهائية.
3Cu2+(aq) + 2PO43-(aq) → Cu3(PO4)3(s)
السؤال الرابع:
في المعادلة الكيميائية الموزونة الآتية:
4NH3 (g) + 5O2 (g) → 6H2O (g) + 4NO (g)
أحسب عدد مولات NO الناتجة من تفاعل 25 mol O2 مع 6 mol NH3
أقسم عدد مولات كل مادة متفاعلة على معاملها (من المعادلة):
4NH3 + 5O2 → 4NO
n NH3 = = 1.5 , n O2 = = 5
المادة المحددة للتفاعل هي: NH3
(4) مول من الأمونيا NH3 ينتج (4) مول من NO .
عدد مولات NO الناتجة: 1.5 مول
السؤال الخامس:
أضيف 0.4 g ثاني أكسيد المنغنيز MnO2 إلى 50 mL من محلول حمض الهيدروبروميك HBr تركيزه 0.02 M ؛ لإنتاج البروم، وبروميد المنغنيز، والماء؛ وفق معادلة التفاعل الموزونة الآتية:
MnO2 (s) + 4HBr (aq) → MnBr2 (aq) + Br2 (l) + 2H2O (l)
أ- أستنتج المادة المحددة للتفاعل.
ب- أحسب كتلة المادة الفائضة.
السؤال السادس:
يتفاعل 80 g من النحاس مع 25 g كبريت لإنتاج كبريتيد النحاس (I) وفق المعادلة الموزونة الآتية:
2Cu (s) + S (s) → Cu2S (s)
أ- أستنتج المادة المحددة للتفاعل.
أحسب عدد مولات النحاس:
n Cu = = 1.26 mol
أحسب عدد مولات الكبريت:
n S = = 0.78 mol
أقسم عدد مولات كل مادة متفاعلة على معاملها (من المعادلة):
2Cu + 1S → Cu2S
n Cu = = 0.63 , n S = = 0.78
المادة المحددة للتفاعل هي: Cu
ب- أحسب كتلة كبريتيد النحاس Cu2S المتكونة.
مولين من النحاس Cu ينتجان مول من كبريتيد النحاس Cu2S .
أحسب عدد مولات كبريتيد النحاس الناتجة:
n Cu2S = = 0.78 mol
أحسب كتلة كبريتيد النحاس الناتجة:
m Cu2S = m x Mr = 0.78 x 105 = 81.9 g
السؤال السابع:
أحسب كتلة كربونات الكالسيوم الناتجة عند إضافة 25 g من كربونات الصوديوم Na2CO3 إلى 20 g كلوريد الكالسيوم CaCl2 وفق المعادلة الموزونة الآتية:
Na2CO3 (aq) + CaCl2 (aq) → CaCO3 (s) + 2NaCl (aq)
السؤال الثامن:
اختر الإجابة الصحيحة في الفقرات الآتية:
1) الأيونات المتفرجة في المعادلة الكيميائية الآتية هي:
AgNO3 (aq) + NaCl (aq) → AgCl (s) + NaNO3(aq)
أ- Ag+ , Cl-
ب- NO3- , Cl-
ج- Na+ , NO3-
د- Ag+ , Na+
2) الأيونات المتفاعلة في المعادلة الأيونية الآتية هي:
H+(aq) + Cl-(aq) + Li+(aq) + OH-(aq) → H2O(l) + Li+(aq) + Cl-(aq)
أ- OH- , Cl-
ب- Li+ , Cl-
ج- H+ , OH-
د- H+ , Cl-
3) المعادلة الأيونية النهائية الصحيحة في ما يأتي هي:
أ- Ni(s) + Cu2+(aq) + SO42-(aq) → NiSO4(aq) + Cu(s)
ب- Ni(s) + Cu2+(aq) + SO42-(aq) → Ni2+(aq) + SO42-(aq) + Cu(s)
ج- Ni2+(aq) + Cu(aq) → Ni(aq) + Cu2+(s)
د- NiSO4(aq) + Cu(s) → Ni(s) + CuSO4(aq)
4) العبارة (تفاعل مادتين أو أكثر لإنتاج مادة واحدة) تشير إلى مفهوم تفاعل:
أ- التحلل.
ب- الترسيب.
ج- الاتحاد.
د- الإحلال المزدوج.
5) عند خلط 3.8 mol A مع 4.5 mol B و 6.6 mol C وفق المعادلة الافتراضية الموزونة الآتية:
3A + 2B → 5D
فإن المادة المحددة للتفاعل هي:
أ- A
ب- B
ج- C
د- AB
السؤال التاسع:
أستنتج من الشكل الآتي كلاً من المادة المحددة والمادة الفائضة في تفاعل ما، حيث تشير الكرات الخضراء إلى جزيء X2 والكرات البيضاء إلى جزيء Y2 .
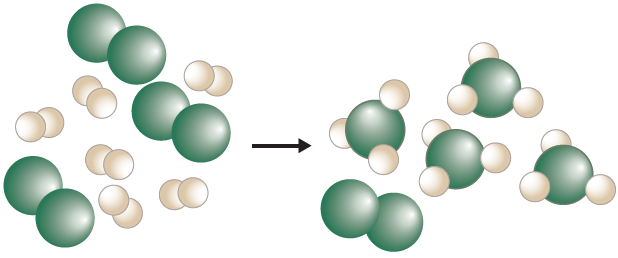
الكرات الخضراء (X2) مادة محددة، والكرات البيضاء (Y2) مادة فائضة.
السؤال العاشر:
أضيف 25 mL من حمض HCl ، تركيزه 0.1 M إلى 10 mL من NaOH ، تركيزه 0.5 M
أ- أكتب معادلة التفاعل الموزونة.
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l)
ب- أكتب المعادلة الأيونية النهائية.
H+ (aq) + OH- (aq) → H2O (l)
ج- أستنتج المادة المحددة للتفاعل.
الحمض.
د- أستنتج المواد الموجودة في وعاء التفاعل بعد اكتمال التفاعل.
H+ , OH- , H2O
السؤال الحادي عشر:
أصنف التفاعلات الآتية إلى أنواعها الرئيسة (الاتحاد، الإحلال الأحادي، الإحلال المزدوج، التحلل)
2HNO3 (aq) + Ca(OH)2 (aq) → Ca(NO3)2 (aq) + 2H2O (l)
2KClO3 (s) 2KCl (s) + 3O2 (g)
Sn (s) + 2AgNO3 (aq) → 2Ag (s) + Sn(NO3)2 (aq)
Mg (s) + 2HCl (aq) → MgCl2 (aq) + H2 (g)
2Na (s) + Br2 (l) → 2NaBr (s)
تصنيف التفاعلات على الترتيب: إحلال مزدوج، تحلل، إحلال أحادي، أحلال أحادي، اتحاد.
السؤال الثاني عشر:
أكتب المعادلة الأيونية النهائية لكلّ من المعادلتين الآتيتين:
CuI2 (aq) + 2KOH (aq) → Cu(OH)2 (s) + 2KI (aq)
Cu2+ (aq) + 2OH- (aq) → Cu(OH)2 (s)
Zn (s) + 2HCl (aq) → ZnCl2 (aq) + H2 (g)
Zn (s) + 2H+ (aq) → Zn2+ (aq) + H2 (g)