 |
حساب تركيز الهيدروكسيد في محاليل القواعد القوية
في حالة القواعد القوية يكون التأين تاماً تقريباً، ويمكن اعتبار [OH-] مساوياً لتركيز القاعدة قبل التأين.
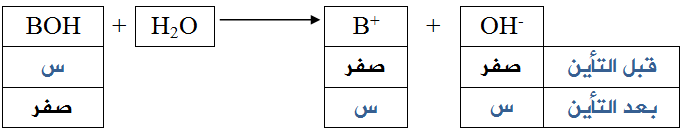
أي أن:
[OH-] بعد التأين = [BOH] قبل التأين
مثال:
احسب قيمة (pH) لمحلول هيدروكسيد الصوديوم NaOH تركيزه (0,1) مول/لتر.
الحل:
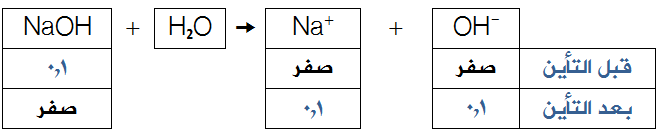
بما أن هيدروكسيد الصوديوم قاعدة قوية، لذا يكون:
[OH-] بعد التأين = [NaOH] قبل التأين = 0,1 مول/لتر.
Kw = [OH-] [H3O+]
1 × 10-14 = 1 × 10-1 [H3O+]
[H3O+] = 1 × 10-13 مول/لتر .
pH = - لــو [H3O+]
= - لــو (1 × 10-13) = 13
سؤال (1):
احسب تركيز كل من OH- و H3O+ وقيمة pH في المحاليل الآتية: (لـو 0,25 = -0,6، لـو 4 = 0,6)
- محلول KOH تركيزه 4 × 10-2 مول/لتر.
- محلول LiOH حُضّر بإذابة 2,5 × 10-4 مول منه في الماء؛ للحصول على محلول حجمه 100 مل.
سؤال (2):
احسب قيمة pH عند إضافة 8غ من NaOH إلى 500 مل من الماء، إذا علمت أن الكتلة المولية لـ NaOH = 40غ/مول. (لـو 0,25 = -0,6 ، Kw = 1 × 10-14).
سؤال (3):
احسب كتلة (LiOH) المذابة في 2,5 لتر من المحلول إذا كانت قيمة pH للمحلول تساوي (13).
(الكتلة المولية لـ H = 1 ، O = 16 ، Li = 7 ، Kw = 1 × 10-14).