 |
أسئلة الفصل الأول
السؤال الأول:
وضح المقصود بكل مما يأتي:
رتبة التفاعل، السرعة الابتدائية للتفاعل، السرعة اللحظية، قانون السرعة، رتبة التفاعل الكلية.
السؤال الثاني:
يتحول N2O4 إلى NO2 في وعاء مغلق، فإذا تمت متابعة التغير في تركيز النواتج بالنسبة للزمن، فأي الأشكال (D , C , B , A) تمثل المعلومات التي تم جمعها؟
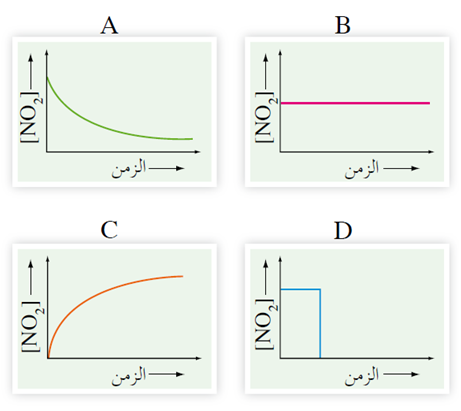
السؤال الثالث:
في التفاعل الآتي:
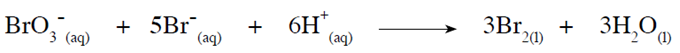
تم الحصول على البيانات الآتية من التجربة العملية:
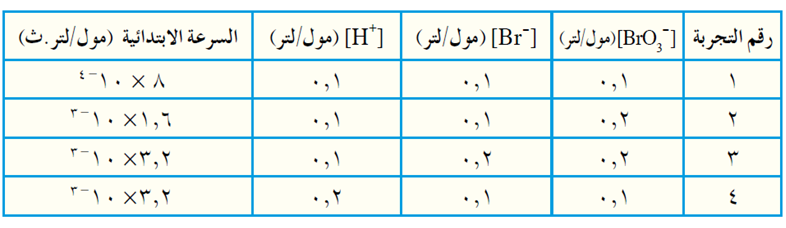
أ) اكتب قانون سرعة التفاعل.
ب) احسب قيمة ثابت السرعة k وما وحدة قياسه؟
ج) ما رتبة التفاعل الكلية؟
السؤال الرابع:
ادرس الجدول الآتي، ثم أجب عن الأسئلة التي تليه:
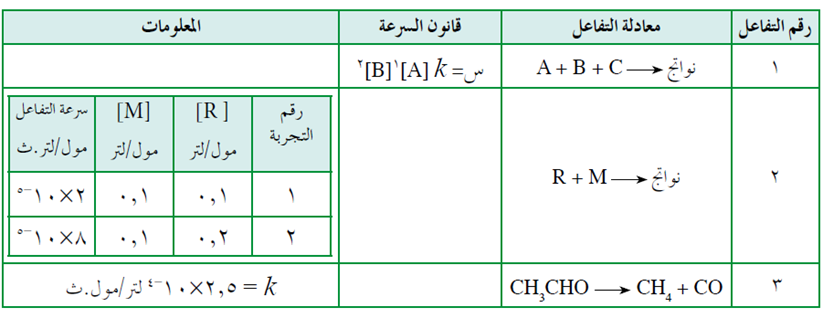
أ) ماذا يحدث لسرعة التفاعل رقم (1) إذا تضاعف [C] ثلاث مرات مع ثبوت العوامل الأخرى؟
ب) اكتب قانون سرعة التفاعل رقم (2) علماً بأن الرتبة الكلية للتفاعل 2
ج) احسب سرعة التفاعل رقم (3) عندما يكون [CH3CHO] = 0,2 مول/لتر، مع ثبوت العوامل الأخرى.
السؤال الخامس:
في التفاعل الافتراضي نواتج → E + 2B
إذا علمت أن قانون سرعة التفاعل هو: س = 1[B] x[E] k
وعند مضاعفة تركيز E 3 مرات وتركيز B 4 مرات تضاعفت سرعة التفاعل 36 مرة. ما رتبة E ؟
السؤال السادس:
مستخدماً البيانات الواردة في الجدول الآتي والمتعلقة بالتفاعل العام: 2D → E + C
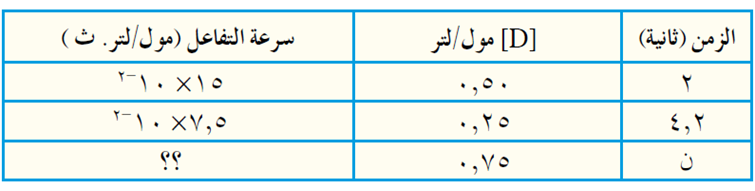
إذا علمت أن قانون سرعة التفاعل هو: س = 1[D] k
أ) احسب سرعة التفاعل عندما يكون تركيز D = 0,75 مول/لتر.
ب) هل قيمة الزمن ن أكبر من 4,2 ثانية أم أقل من 2 ثانية؟ وضّح إجابتك.
السؤال السابع:
في التفاعل الآتي: A + 2B → 3C + D
إذا علمت أن قيمة ثابت السرعة k للتفاعل عند درجة حرارة معينة يساوي 2 × 10-3 لتر/مول.ث، وأن قانون سرعة التفاعل هو: س = x[A] k
أ) ما رتبة التفاعل بالنسبة لكل من A و B ؟
ب) احسب سرعة التفاعل عندما يكون تركيز A = 0,1 مول/لتر، وتركيز B = 0,5 مول/لتر.
ج) كم مرة تتضاعف سرعة التفاعل عند مضاعفة [A] مرتين، و [B] ثلاث مرات؟